Поурочные разработки по химии 11 класс
Оксиды - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: закрепить знания о классификации и номенклатуре; химических свойствах оксидов, научить составлять уравнения реакций, подтверждающие эти свойства; закрепить навыки решения расчетных задач по химическим уравнениям и по формуле.
Основные понятия: солеобразующий, несолеобразующий оксид, основной, кислотный, амфотерный оксид.
Оборудование: CaO, CuO, ZnO, СаСО3, S, ложечка для сжигания веществ, газоотводная трубка, вода, набор реактивов, пробирки, спиртовка, держатель.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
Анализ результатов зачета по теме «Неметаллы». Предложить учащимся сделать работу над ошибками.
План изложения
1. Определение оксидов. Классификация, номенклатура, физические свойства оксидов, химическая связь, тип кристаллических решеток.
2. Химические свойства: а) солеобразующих оксидов: основных оксидов, кислотных оксидов, амфотерных оксидов; б) несолеобразующих оксидов.
3. Получение оксидов.
4. Решение расчетных задач.
II. Фронтальная работа
Напомнить учащимся изученный вопрос о классификации неорганических сложных веществ. Работая со схемой 6 с. 179 и конспектом в рабочей тетради, учащиеся вспоминают определение оксидов, их классификацию, номенклатуру, особенности физических свойств и строение.
Из приведенных формул оксидов выписать оксиды: а) солеобразующие: основные, кислотные, амфотерные; б) несолеобразующие. Дать им названия.
Na2О, N2О5, NaOH, HNО3, CuO, SО2, CO, SCl2, Cl2O5, Mn2O7, FeS, Fe2O3, Cu2O, P2O5, N2O, ZnCl2, MgO, Cr2O3, CrO3, ZnO.
Ответ: солеобразующие оксиды:
а) основные:
Na2O — оксид натрия, Сu+2O — оксид меди (II), Fe2+3O3 — оксид железа (III), MgO — оксид магния, Cu2+1O — оксид меди (I).
б) кислотные оксиды: N2+5O5 — оксид азота (V), S+4O2 — оксид серы (IV), Сl2+5O5 — оксид хлора (V), Мn2+7O7 — оксид марганца (VII), Р+5O5 - оксид фосфора (V), Сr+6O3 — оксид хрома (VI).
в) амфотерные оксиды: Cr2+3O3 — оксид хрома (III), ZnO — оксид цинка.
Несолеобразующие оксиды: N2+1O — оксид азота (I), С+2О — оксид углерода (II).
Особенности физических свойств оксидов:
газообразные: SO2, СО, N2O;
жидкие: Мn2O7, СrO3;
твердые: N2O5, Fe2O3, СаО, Р2O5.
По строению, виду химической связи: ковалентная полярная связь SO2, СО и т.д., ионная связь Na2O, CuO и т. д.
Типы кристаллической решетки: ионные, атомные, молекулярные.
Особенности химических свойств оксидов:
а) основные оксиды:

Эксперимент:

Эксперимент: CaO + Н2О = Са(ОН)2 + Q — фенолфталеин — малиновый цвет,
б) кислотные оксиды:
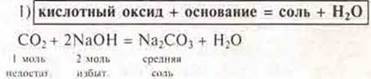
![]()
Эксперимент:
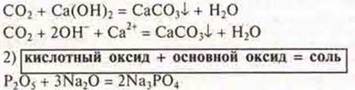
3) Большинство кислотных оксидов взаимодействуют с водой.
![]()
Эксперимент: SО2 + Н2О = H2SО3 — метилоранж — розовый цвет.
SiО2 + Н2О ≠
в) амфотерные оксиды. Проявление свойств основных оксидов — взаимодействуют с кислотами и кислотными оксидами:
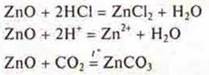
Проявление свойств кислотных оксидов — взаимодействие с растворимыми основаниями и с основными оксидами:
![]()
Эксперимент:
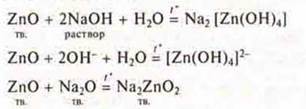
Получение оксидов:

2) Разложение кислородсодержащих кислот.
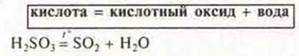
3) Разложение нерастворимых оснований.
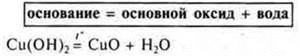
4) Разложение некоторых солей.
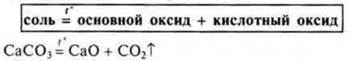
III. Выполнений заданий
I) С какими из следующих веществ будут реагировать:
а) ВаО; б) Аl2O3; в) N2O5; SO3; Р2O5; CaO, NaOH, HNO3 Na2SO4.
Ответ:
а) ВаО — основной оксид:
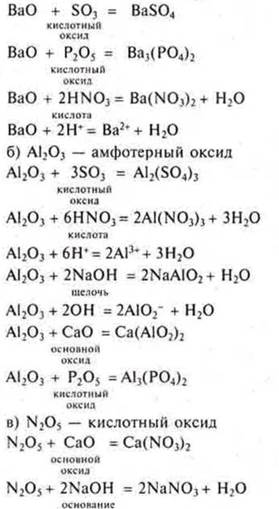
IV. Решение расчетных задач
а) по формуле; б) химическому уравнению,
а) Массовая доля азота будет наименьшей в оксиде:
N2O, NO, NO2, N2O5.
Решение:
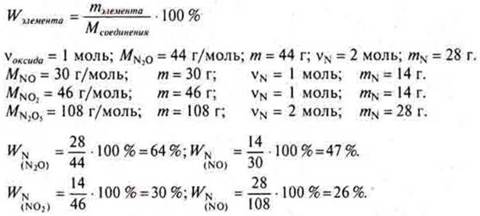
Ответ: Наименьшая массовая доля азота в оксиде азота(V) N2O5 26 %.
б) Оксид натрия массой 12,4 г растворили в воле. Какой объем углекислого газа (н.у.) потребуется для нейтрализации полученного раствора гидроксида натрия, если образуется при этом кислая соль?
Решение:
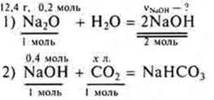
Из уравнения (1):

Из уравнения (2):

Ответ: потребуется 8,96 л СO2.
V. Домашнее задание
1) Конспект в тетради.
2) Составить уравнения реакций, подтверждающие свойства оксидов: Li2O, ВеО, P2O5.
3) Задача 1. Вычислить массовую долю элемента, образовавшего оксиды: оксид марганца (II), оксид марганца (IV), оксид марганца (VII). В каком оксиде наибольшая W элемента?
4) Задача 2. При пропускании оксида углерода (IV) через раствор гидроксида кальция получили кислую соль — гидрокарбонат кальция массой 8,1 г. Определить объем оксида углерода (IV) (н.у.), который был пропущен через раствор.