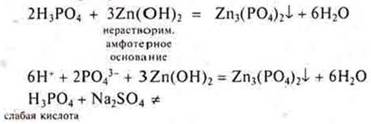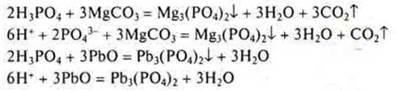Поурочные разработки по химии 11 класс
Органические и неорганические кислоты - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить, закрепить знания о классификации, номенклатуре, физических и химических свойствах кислот: органических и неорганических кислот; научить объяснять общность химических свойств неорганических и органических кислот и правильно составлять уравнения реакций в молекулярном и ионном виде.
Основные понятия: кислородсодержащие и бескислородные кислоты, основность кислот, летучая и нелетучая кислота, сильная и слабая кислота, стабильная и нестабильная кислота, электрохимический ряд напряжений металлов.
Оборудование: набор реактивов: Mg, Сu, Н3С — СООН, С2Н5ОН, СаО, ZnO, H2SO4(к), Ag2O(NH3 · Н2O), 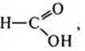 пробирки, спиртовка, держатель для пробирок.
пробирки, спиртовка, держатель для пробирок.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания.
Первый ученик: на доске выполняет задание 2 (Li2O, P2O5, ВеО).
Второй ученик: решение задач 1, 2.
III. Фронтальная работа
Задание. Составить формулы оксидов элементов № 38, N° 56, № 30. Назвать их, классифицировать и составить по одному уравнению, подтверждающему их химические свойства.
Ответ: Li2O — основной оксид, ВеО — амфотерный оксид, Р2O5— кислотный оксид.
Li2O — основной оксид, оксид метил, солеобразующий, образован очень активным металлом, взаимодействует с Н2O, кислотами, кислотными оксидами, амфотерными оксидами.
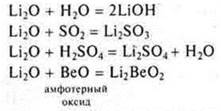
Р2O5 — оксид фосфора(V), солеобразующий, кислотный, образован неметаллом, может взаимодействовать с водой, щелочами, основными и амфотерными оксидами.

ВеО — амфотерный солеобразующий оксид, образован переходным элементом. Как основной оксид реагирует с кислотными оксидами и кислотами.
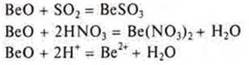
Как кислотный оксид реагирует с щелочами и основными оксидами.
![]()
По свойствам ВеО возможен ответ: с оксидами Li2О и Р2О5 (в целях экономии времени).
IV. Решение задач
Задача 1
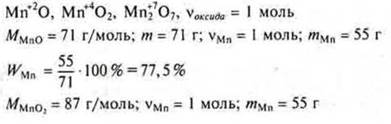
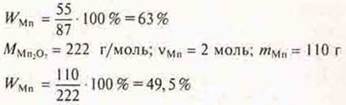
Ответ: наибольшая WMn в оксиде МnО.
3адача 2

Ответ: требуется 4,9 л СO2.
Формулы оксидов элементов № 38, 56, 30.
№ 38 — Sr — стронций. С.О. +2.
SrO — оксид стронция, основной оксид солеобразуюший образован щелочноземельным элементом.
![]()
№ 56 — Cs — цезий. С.О. +1
Cs2O — оксид цезия, основной оксид, солеобразующий, образован щелочным металлом.
![]()
№ 30 — Zn — цинк С.О. +2
ZnO — оксид цинка амфотерный оксид, солеобразующий, образован переходным элементом, как основной оксид с кислотой.
![]()
Как кислородный оксид с щелочами
![]()
V. Изучение нового материала
План изложения
1. Определение, классификация, номенклатура, химическая связь, тип кристаллической решетки.
2. Протолитическая и электронная теории кислотно-основных свойств соединений.
3. Общие химические свойства неорганических и органических кислот в свете теории электролитической диссоциации.
а) действие на индикаторы
б) взаимодействие с металлами, оксидами металлов, основаниями растворимыми и нерастворимыми, солями.
Задание: Из приведенных формул соединений выписать кислоты, дать им названия согласно классификации на с. 179, схема 7 учебника.
KHSO4, СO2, H2SO4, Cu(OH)2, Н3РO4, HCl, ВаНРO4, H2S, HNO2, Na2SO3, H2SO3, CH3COONa, CH3COOH, HCOOH, C17H35COOK, C17H35COOH.
Кислоты — это сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металла и кислотного остатка. Общая формула: НnAс.
Кислоты бескислородные:
HCl — соляная кислота,
H2S — сероводородная кислота.
Кислоты кислородсодержащие:
H2SO4 — серная кислота;
Н3РO4 — ортофосфорная (фосфорная) кислота;
H2SO3 — сернистая кислота;
HNO2 — азотистая кислота;
СН3СООН — уксусная кислота, этановая кислота;
НСООН — метановая кислота (муравьиная кислота):
С17Н35СООН — стеариновая кислота.
Однако есть более полная классификация кислот. В учебнике она предлагается на с. 246, таблица 17. Согласно этой классификации опишем кислоты:
H2SO4 — серная кислоты, кислородсодержащая, двухосновная, растворимая, нелетучая, сильная, стабильная.
HCl — соляная кислота, бескислородная, одноосновная, растворимая, сильная, летучая, стабильная.
H2S — сероводородная кислота, бескислородная, двухосновная, растворимая, слабая, летучая, стабильная.
H2SO3 — сернистая кислота, кислородсодержащая, двухосновная, растворимая, нестабильная, нелетучая, слабая.
СН3СООН — этановая (уксусная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
HNO2 — азотистая кислота, кислородсодержащая, одноосновная, растворимая, слабая, нелетучая, стабильная.
НСООН — метановая (муравьиная) кислота, кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная.
С17Н35СООН — стеариновая кислота, кислородсодержащая, нерастворимая, нелетучая, слабая, стабильная.
Далее учитель предлагает учащимся определение кислот в свете теории электролитической диссоциации.
Кислоты — это электролиты, в водных растворах которых в качестве катиона присутствует катион водорода:
![]()
Однако в 1923 г. была предложена протолитическая теория Бернстедом-Лаури, которая расширила представления о кислотах и основаниях. Эта теория объясняла поведение веществ в водных и неводных растворах.
Согласно этой теории кислоты — это молекулы или ионы, которые являются в данной реакции донорами (дающие) катионов водорода Н+:
![]()
Кислота — донор катиона водорода. Катион водорода называется протоном, поэтому теория называется протолитической. Согласно электронной теории кислот и оснований американского химика Г. Н. Льюиса один из соединяющихся атомов отдает на образование химической связи свою свободную электронную пару, а другой атом предоставляет свою свободную электронную ячейку (орбиталь). Первый атом — донор электронов, второй атом — акцептор (принимающий) — идет образование химической связи по донорно-акцепторному механизму.
В соответствии с этим Г.Н. Льюис сформулировал новое представление о кислотах и основаниях. Кислоты — те реагенты, которые являются акцепторами электронов. Основания — те реагенты, которые выступают донорами электронных пар.
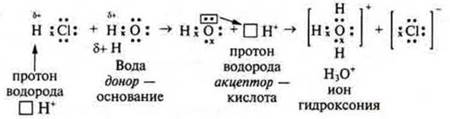
Н3O+ — ион гидроксония. Присутствует в растворах всех кислот, но и он может выступать в роли кислоты — отдавать протон и превращаться в молекулу воды. В уравнениях реакций для простоты записи будем пользоваться обозначением иона гидроксония — Н+.
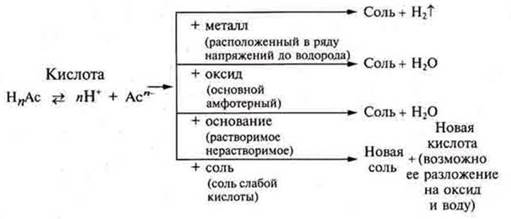
Общие химические свойства кислот органических и неорганических: кислый вкус, изменение цвета индикаторов, взаимодействие с металлами, оксидами основными и амфотерными, основаниями растворимыми и нерастворимыми, солями, обусловлены катионами водорода в растворах.
Диссоциация в водных растворах
Сильные кислоты, α → 1:
![]()
Слабые кислоты, α → 0:
![]() - ступенчатая диссоциация
- ступенчатая диссоциация
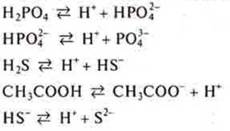
Изменение цвета индикаторов:
а) метилоранж — розовый цвет;
б) фенолфталеин — без изменений;
в) синий лакмус — красный цвет;
г) универсальный индикатор — от желтого до розового цвета.
Далее учитель экспериментально доказывает свойства кислот, учащиеся самостоятельно записывают на доске и в тетрадях уравнения реакций взаимодействия с металлами, расположенными в электрохимическом ряду напряжений металлов до водорода.
Эксперимент:
![]() - неорганическая кислота
- неорганическая кислота
![]()
Эксперимент:
![]() - органическая кислота
- органическая кислота
![]()
Взаимодействие с основными и амфотерными оксидами
Эксперимент:
![]() - неорганическая кислота
- неорганическая кислота
![]()
Эксперимент:
![]() — органическая кислота
— органическая кислота
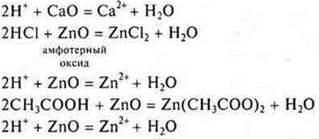
Уравнения реакций с амфотерным оксидом учащиеся самостоятельно записывают на доске и в тетрадях.
Взаимодействие с растворимыми и нерастворимыми основаниями
Многоосновные кислоты могут образовывать кислые соли и средние соли. Это реакции нейтрализации.
Растворимое основание:
![]() — кислота неорганическая
— кислота неорганическая
![]() — кислота неорганическая
— кислота неорганическая
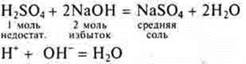
![]() - органическая кислота
- органическая кислота
Нерастворимое основание
Эксперимент:
![]() — кислота неорганическая
— кислота неорганическая
![]()
Эксперимент:
![]() — органическая кислота
— органическая кислота
![]()
Взаимодействие с солями
Следует помнить, что сильная кислота способна вытеснить слабую кислоту даже из нерастворимой соли.
Эксперимент
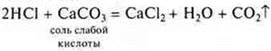 — неорганическая кислота
— неорганическая кислота
![]() — образуются газ, вода
— образуются газ, вода
Эксперимент:
![]()
![]() — органическая кислота Обобщение общих химических свойств неорганических и органических кислот следует записать в виде схемы.
— органическая кислота Обобщение общих химических свойств неорганических и органических кислот следует записать в виде схемы.
VI. Домашнее задание
§ 20 до стр. 248. № 1, 2, свойства H2SО4.
VII. Закрепление
Задание: С какими из перечисленных веществ будет взаимодействовать Н3РО4: К, SiО2, Zn(OH)2, Na2SО4, MgCО3, PbO, Cu? Составить соответствующие уравнения реакций в молекулярном и ионном виде.
Н3РО4 — фосфорная кислота,
Н3РО4 — кислота средней силы, в растворе присутствуют ионы Н2РО4-; НРО42- и РО43-. Фосфат-ионов меньше, но идет их связывание в осадок, возможно написание уравнения с диссоциацией до фосфат-иона.
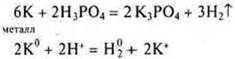
![]() — не взаимодействует
— не взаимодействует
![]() — не взаимодействует
— не взаимодействует