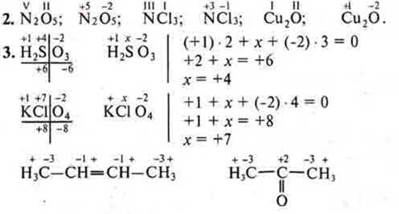Поурочные разработки по химии 11 класс
Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома
Цели урока: дать представление о попытках классификации химических элементов и их состоятельности, которые разрабатывали предшественники Д.И. Менделеева, а также основные сведения об открытии закона Д.И. Менделеевым; научить давать формулировку закона по Менделееву, а также современную на основе учения о строении атома; закрепить знание структуры периодической системы; физического смысла номера периода, номера группы, порядкового номера.
Основные понятия: Периодический закон, Периодическая система, изотопы, химический элемент, физический смысл порядкового номера, номер периода, номер группы; структура периодической системы, периодичность вертикальная, диагональная, горизонтальная, «звездная».
Оборудование: ПСХЭ Д.И. Менделеева, портреты Д.И. Менделеева в разные годы; портреты «химиков-предшественников».
Ход урока
I. Проверка выполнения домашнего задания
Ответы на вопросы § 4
№ 1. Валентные возможности атомов химических элементов определяются числом неспаренных электронов, наличием свободных орбиталей, а также наличием неподеленных электронных пар в атоме.
№ 2. На втором энергетическом уровне возможно открытие четырех орбиталей: 2s — одна орбиталь и 2р — три орбитали.
№ 3. Валентность — количество общих электронных пар, которые атом образует с другими атомами.
№ 4. С.О. — условный заряд, который приобретает атом в соединении, если считать, что в соединении ионные связи.
И в том, и в другом случае участие принимают электроны.
№ 5
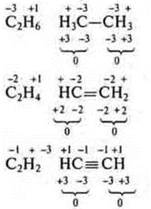
№ 6.
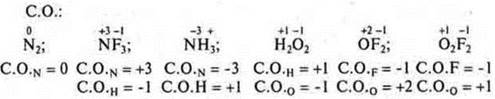
Валентность:
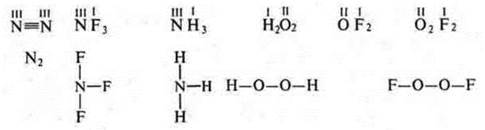
№ 17. Сера (S): + 16, 16e-.
![]()
Валентные возможности атома серы в основном состоянии.
Валентность два, т.к. два неспаренных электрона; атом-донор, может быть валентность 3 и 4.
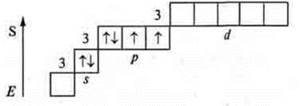
Валентные возможности атома серы в возбужденном состоянии.
Первое возбужденное состояние
Валентность — четыре, как атом-донор — пять.
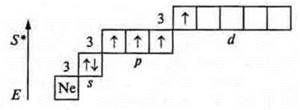
Второе возбужденное состояние
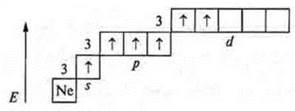
Валентность — шесть.
I. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Сравнить валентные возможности атомов |
|
|
кислорода и серы |
азота и фосфора |
|
в основном и возбужденном состоянии. Одинаковы ли они. Дать обоснованный ответ. |
|
|
2. Определить валентность и С.О. элементов в соединениях |
|
|
|
|
|
3. Определить С.О. элементов в соединениях |
|
|
|
|
II. Изучение нового материала
План изложения
1. Введение в изучение данного вопроса (слово учителя). Периодический закон и Периодическая система химических элементов Д.И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе и поэтому никогда не потеряют своего значения (учебник, с. 26 § 5).
Изучая данный вопрос, подумайте над следующим: многие ученые занимались поисками естественной классификации химических элементов, находились в равных условиях, имели одни и те же предпосылки (см. учебник, с. 26—29). Почему же ни одному из них, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
Далее идут сообщения учащихся по определенным вопросам и рассказ учителя.
Если сообщений нет, то возможна работа учащихся с учебником в момент рассказа учителя в той же последовательности, в какой предполагались сообщения учащихся.
2. Сообщения учащихся (либо рассказ учителя, работа с текстом учебника по наводящим вопросам согласно темам сообщений).
Если предусмотрены сообщения учащихся, то план следующий:
Сообщение 1
Предпосылка открытия Периодического закона Д.И. Менделеева. Съезд химиков в Карлсруэ.
В этом сообщении раскрывается работа ученых — предшественников Д.И. Менделеева:
— классификация Берцелиуса;
— триады Деберейнера (1816 г.);
— спираль Шанкуртуа (1862 г.);
— октавы Ныолендсена (1865 г.);
— таблица Мейера (1864 г.).
Объясняется несостоятельность попыток классификации, а также учащиеся знакомятся с важным значением в открытии Периодического закона съезда химиков в Карлсруэ 1860 г.
Сообщение 2
Открытие Д.И. Менделеевым Периодического закона.
В этом сообщении:
1) знакомство с личностными качествами русского ученого Д.И. Менделеева, его жизнью, творческим наследием;
2) основные положения, на которые опирался в своем открытии Д.И. Менделеев;
3) структура Периодической системы, предложенной Д.И. Менделеевым: естественные группы, периоды;
4) изменение свойств химических элементов, простых веществ, а также сложных соединений или образуемых в периодах — горизонтальная периодичность:
5) Периодический закон, сформулированный Д.И. Менделеевым I марта 1869 г. (учебник, с. 32).
Далее учитель может объяснить периодические закономерности: вертикальную (по группам) и диагональную.
Лучше всего диагональная периодичность свойств неметаллов характеризуется по диагонали В—Si—As—Те—At, которая условно делит элементы на металлы и неметаллы (или диагональ С— Р—Se—I). Две диагонали AI—Le—Sb и Zn—Tn—Pb включают элементы и их соединения с амфотерными свойствами.
Вертикальная периодичность показывает изменения свойств элементов, соединений, образованных ими в группах, главных подгруппах. С ростом порядкового номера усиливающаяся металличность основной характер соединений, ослабевает неметалличность, уменьшается прочность летучих водородных соединений, увеличивается их кислотность.
Если объединить горизонтальную вертикальную и диагональную периодичность, то можно получить «звездную периодичность». Эго позволило Д. И. Менделееву не только предсказать, описать свойства веществ, образованных еще не открытыми химическими элементами, но и указать пути их открытия, природные источники, из которых могли быть получены соответствующие простые вещества.
Сообщение 3
История предсказания элементов № 21 — экабор, 31 — экаалюминий Д. И. Менделеевым и их открытие.
Однако новые научные открытия стали вступать в противоречие с формулировкой Периодического закона по Д. И. Менделееву: открытие изотопов дало возможность считать химическими элементами виды атомов, характеризующихся одинаковыми зарядами ядра, т.е. содержащих одинаковое число протонов.
Изотопы известны у всех химических элементов. В природе большинство их существует в виде смеси изотопов. Относительная атомная масса элемента равна среднему значению относительной атомной массы всех его природных изотопов с учетом их распространенности.
Задача.
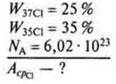
1) N — количество атомов смеси изотопов.
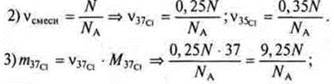
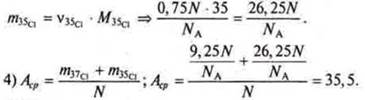
В Периодической системе под символами химических элементов приведены средние значения их относительных масс.
Следует сделать вывод, что наличие изотопов доказывает, что свойства химических элементов определяются не столько их атомной массой, как предполагал Д. И. Менделеев, сколько зарядом их атомных масс.
Этим и объясняется положение в системе четырех пар элементов, размещенных с нарушением принципа возрастания атомных масс.

Гениальность Д. И. Менделеева, проявление им научной интуиции состоит в том, он предпочел расположить по сходству в свойствах, тем самым предугадав истинный порядок размещения химических элементов по возрастанию зарядов их атомных ядер, хотя о строении их атомов ничего не знал. Теоретически Ван-де-Брук (Голландия) и экспериментально Г. Мозли (Германия) доказано, что заряд ядра атома соответствует его порядковому номеру.
Таким образом, открытия изотопов и соответствие заряда ядра порядковому номеру химического элемента позволили дать современное определение Периодического закона.
Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
III. Закрепление и обобщение изученного материала по узловым вопросам
1. Исходные положения, на которые опирался в открытии закона Д. И. Менделеев.
2. Формулировка Периодического закона Д. И. Менделеевым.
3. Периодичность вертикальная, горизонтальная, диагональная, «звездная».
4. Изотопы. Современная формулировка Периодического закона.
5. Структура периодической системы:
а) периоды;
б) группы.
6. Физический смысл:
а) порядкового номера;
б) номера периода;
в) номера группы в свете строения атома. Объяснить на примере элементов № 18, 101, 74.
IV. Домашнее задание
§ 5 до раздела «Подготовка к химическому диктанту».
Ответы на вопросы самостоятельной работы
Вариант I
1. Кислород
![]()
Основное состояние
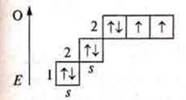
Сера
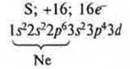
Основное состояние
У атомов на внешнем энергетическом уровне два неспаренных электрона и есть две пары спаренных электронов, это атомы-доноры, валентные возможности одинаковы — два, три, четыре. У атома кислорода невозможно состояние возбуждения, т. к. на втором энергетическом уровне нет возможности открытия подуровня d и распаривание электронов на 3s требует огромных затрат Е, что невозможно.
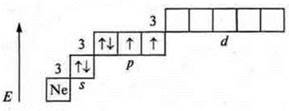
У атома серы возможно возбужденное состояние, т.к. на третьем энергетическом уровне открывается d-подуровень.
Валентность четыре и пять, как у атома-донора.
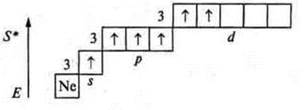
Валентность шесть.
Вариант II
1. Азот
![]()
Фосфор
![]()
У атомов в основном состоянии на внешнем энергетическом уровне три р-электрона неспаренных и пара s-спаренных электронов.
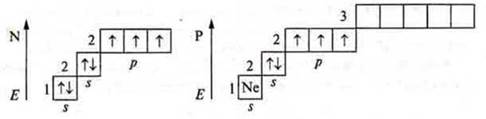
Они могут проявить валентность три и четыре, как атомы-доноры.
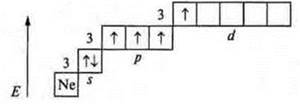
У атома азота невозможно состояние возбуждения, т. к. на втором энергетическом уровне нет подуровня d; переход на третий энергетический уровень требует огромных затрат энергии, что невозможно. У атома фосфора возбужденное состояние возможно, т. к. открывается 3d-подуровень.
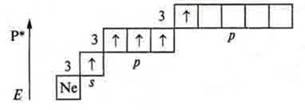
Валентность атома фосфора — 5.