Поурочные разработки по химии 11 класс
Изменение свойств элементов и их соединений в зависимости от положения в Периодической системе. Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева
Цели урока: закрепить знание причины изменения свойств элементов на основании положения в системе; научить обоснованно объяснять и сравнивать свойства элементов, а также образованных ими простых и сложных веществ; научить давать полную характеристику химического элемента в ПСХЭ; дать представление о значении Периодического закона и Периодической системы химических элементов для развития науки, промышленности.
Оборудование: ПСХЭ Д.И. Менделеева, кодотранспоранты.
Ход урока
I. Организационный момент
Проверка знаний учащихся: химический диктант по вариантам; предполагает быструю работу, используя ПСХЭ Д.И. Менделеева.
1. Указать элемент, в атоме которого:
а) 25 протонов а) 41 протон
б) 13 электронов б) 20 электронов
2. Назвать два элемента, в атоме которых:
три энергетических уровня пять энергетических уровней.
3. Определить два элемента, в атоме которых на последнем энергетическом уровне:
4 валентных электрона 7 валентных электронов
4. Указать место положения элементов в ПСХЭ.
а) № 37 а) № 24
б) № 30 б) № 50
5. Чем сходны и чем отличаются по составу атомы
![]()
6. Дать формулировку Периодического закона:
по Д.И. Менделееву современную
II. Изучение нового материала
План изложения
1. Причины изменения свойств элементов на основании положения в ПСХЭ:
а) в периодах (малых, больших);
б) группах, главных подгруппах;
2. Изменение свойств химических элементов и образованных ими соединений:
а) в периодах;
б) группах, главных подгруппах.
3. Значение Периодического закона и Периодической системы химических элементов Д.И. Менделеева (возможны сообщения учащихся).
4. План характеристики химического элемента на основании его положения в ПСХЭ.
В чем же причины изменения свойств химических элементов? Каковы причины периодичности? Чтобы ответить на данные вопросы сравним атомы элементов:
а) № 11 - Na, № 15 - Р, № 17 - Сl, № 18 - Аr;
б) № 3, № 19, № 37.
1. Какой заряд ядра данных атомов, что с ним происходит?
Ответ:
а) Na — +11, Р — +15, Cl — +17, Аr — +18; заряд ядра возрастает к концу периода постепенно;
б) Li — +3; К — +19; Rb — +37; заряд ядра возрастает быстро к концу группы, главной подгруппы.
2. Определить количество электронов на внешнем энергетическом уровне. Что наблюдается?
Ответ:
а) Na — 1е-; Р — 5е-; Сl — 1е-; Аr — 8е-. Количество электронов на внешнем энергетическом уровне возрастает постепенно к концу периода.
б) Li — 1е-, К — 1e-, Rb — 1е-. Количество электронов на внешнем энергетическом уровне остается неизменным к концу группы, главной подгруппы.
3. Сколько энергетических уровней в атомах данных элементов, что наблюдается?
Ответ:
а) Na — три, Р — три, Сl — три, Аr — три. Количество энергетических уровней не изменяется, одинаково.
б) Li — два, К — четыре, Rb — пять. Количество энергетических уровней возрастает к концу группы главной подгруппы.
4. Как Вы считаете, что же происходит с атомным радиусов, вследствие данных изменений?
а) к концу периода;
б) к концу группы, главной подгруппы.
Ответ:
а) к концу периода атомный радиус уменьшается вследствие усиленного взаимопритяжения ядра атома и электронов внешнего энергетического уровня (работа с таблицей).
б) к концу группы, главной подгруппы атомный радиус возрастает т. к. увеличивается количество энергетических уровней в атоме.
5. Сказываются ли такие изменения атомных радиусов в периодах и группах, главных подгруппах на способность атомов отдавать электроны, или их присоединениях?
Ответ:
При уменьшении атомного радиуса ослабевает способность атомов отдавать электроны, усиливается способность принимать электроны. К концу периода атомы элементов легче принимают электроны, что обеспечивает проявление неметалличности. При увеличении атомного радиуса возрастает способность атомов отдавать электроны. К концу группы, главной подгруппы атомы элементов легче отдают электроны, что обеспечивает проявление металличности.
В малых периодах изменение свойств элементов происходит быстро, в больших периодах медленно, т. к. у атомов достраивается превнешний энергетический уровень, а в сверхбольших периодах (VI, VII) изменения происходят еще медленнее, т. к. у лантаноидов и актиноидов достраивается не внешний или предвнешний, а третий снаружи уровень с 18е- до 32е-, вследствие чего свойства этих элементов сходны между собой, и эти элементы образуют семейства лантаноидов и актиноидов.
6. В чем же причина периодичностного изменения свойств элементов? Сравните строение атомов элементов № 3, 11, 19, 37. В чем их сходство и в чем различие?
Ответ:
Это элементы Li, Na, К, Rb. Они расположены в I группе главной подгруппе, имеют одинаковое строение внешнего энергетического уровня Li — 2s', Na — 3s', К — 4s', Rb — 5s'.
Однако у каждого из данных элементов электрон внешнего энергетического уровня расположен на разном удалении от ядра атома, вследствие чего химическая активность их разная, но свойства их сходны. Причиной периодичности и является изменение строения внешнего, а также предвнешнего энергетического уровня; повторение числа электронов внешнего (предвнешнего) энергетического уровня.
Далее и качестве вывода по данному пункту составляется краткая схема:
В периодах (к концу периода)

В группах, главных подгруппах (к концу главных подгрупп)

Периодичность изменения свойств элементов сказывается и на свойствах простых веществ, образованных ими и на свойствах более сложных соединений: оксидов и гидроксидов.
Учащимся предлагается ознакомиться с табл. 6 учебника. Особенно поработать с изменением свойств простых веществ в периодах и группах, главных подгруппах, более подробно рассмотреть изменение свойств высших оксидов и гидроксилов в периодах и группах, главных подгруппах.
В периодах характер химических свойств высших оксидов изменяется от основного до кислотного, причина та же — атомный радиус иона уменьшается. С.О. — возрастает.
III период 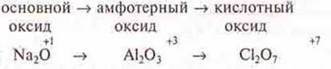
Характер гидроксидов изменяется так же.
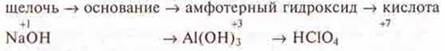
Таким образом, к концу периода в сложных соединениях: оксидах и гидроксидах — наблюдается ослабление основных свойств и усиление кислотных.
Если рассматривать группы, главные подгруппы, где наблюдается усиление металличности к концу группы, то следует сделать вывод, что происходит усиление основного характера оксида, гидроксида, от кислотного, через амфотерный.
Пример: III группа, главная подгруппа.
![]()
Если рассмотреть I группу, главную подгруппу, то наблюдается усиление основного характера, так как это типичные металлы. Гидроксиды, образуемые данными элементами — сильнейшие основания — щелочи.
Каково же значение Периодического закона и Периодической системы?
По данному вопросу возможно сообщение учащихся (подготовленное заранее), либо учитель акцентирует внимание учащихся на таких выводах, которые можно записать на кодотранспоранте.
Можно разделить познание Периодического закона на два этапа: первый этап — при жизни Д. И. Менделеева, второй этап — современное развитие.
Первый этан познания
1. Свойства химических элементов, простых веществ, форма и свойства соединений элементов находятся в периодической зависимости от атомных весов.
2. Закон объясняется на основе атомно-молекулярной теории.
3. Химический элемент понимали как вид атомов с одинаковой относительной атомной массой.
4. Сделана перестановка элементов:
Аr — К, Со — Ni, Те — I. Причина ее не установлена.
5. Причина периодичности свойств элементов не ясна.
Значение закона на первом этапе:
1. Исправлены атомные массы некоторых элементов.
2. Дана научная классификация элементов на основе периодического закона с учетом их атомных масс и химических свойств.
3. Пересказано открытие ряда элементов. Описаны подробно свойства экабора, экаалюминия, экокремния.
4. Открыты инертные газы.
Второй этап познания:
1. Свойства химических элементов простых веществ. Форма и свойства соединений находятся в периодической зависимости от величины заряда атомных ядер.
2. Закон объясняется на основе теории строения атома.
3. Химический элемент принимают как вид атома с одинаковым зарядом ядра.
4. Объяснена причина перестановки Аr — К, Со — Ni, Те — I.
Элементы поставлены в соответствии с зарядом их атомных ядер.
У впередистоящего элемента больше тяжелых изотопов, поэтому его относительная атомная масса больше.
5. Объяснена причина периодичности свойств элементов: периодически повторяется число электронов на внешнем (предвнешнем) энергетическом уровне.
Значение закона на втором этапе:
1. Создана теория строения атома.
2. Дана научная классификация химических элементов на основе периодического закона и строения атомов элементов.
3. Определена естественная граница периодической системы.
4. Открыты элементы № 43, 61, 72, 75, 85, 87, 91.
5. Синтезированы элементы № 93-109-111.
6. Сделаны открытия в науках: физике, геологии, биологии.
7. Значение закона для учебных целей:
а) значительно сокращено время на изучение свойств элементов, появляется возможность прогнозирования их свойства;
б) формулируется убеждение, что окружающий мир един, т.к. состоит из одних и тех же химических элементов, и он познаваем.
На данном уроке следует ознакомить учащихся с планом характеристики химического элемента по его положению в ПСХЭ. В данной характеристике учащиеся показывают свои знания периодического закона Периодической системы и умения ими пользоваться правильно.
План характеристики химического элемента по его положению в ПСХЭ Д.И. Менделеева
I. Название элемент, химический знак, относительная атомная масса, порядковый номер; номер периода, номер группы, подгруппы — главная или побочная.
II. Строение атома элемента:
а) заряд ядра атома; количество протонов, нейтронов в ядре атома; количество электронов в атоме;
б) электронная формула атома и электронно-графическое изображение; семейство s-, р-, d-, f-; металлический или неметаллический элемент; С.О. — максимальная, минимальная.
III. Внешний оксид, характер высшего оксида; химические свойства высшего оксида (предложить несколько уравнений реакций.
IV. Гидроксид, характер гидроксида (основания, кислота) химические свойства гидроксида (составить несколько уравнений реакций).
V. Водородное соединение; характер водородного соединения (основной, кислотный).
VI. Дать сравнение данного элемента с рядом стоящими по периоду; по группе, главной подгруппе (сравнивается его металличность или неметалличность).
В качестве примера для закрепления учащимися знаний можно предложить характеристики металлического (Са) и неметаллического (Cl) элементов, составленные на кодотранспоранте или отпечатанные на карточках.
Металлический элемент
I. Кальций (Са); АrСа = 40;
№ 20; IV период; II группа, главная подгруппа.
II. а) +20; 20 протонов: 40 + 20 = 20 нейтронов;
20 электронов;
б) ![]() s-элемент;
s-элемент;
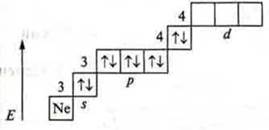
металлический элемент; С.О. +2.
![]()
III. СаО — оксид кальция; основной:
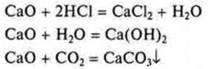
IV. Са(ОН)2 — гидроксид, основание:
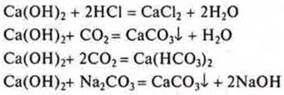
V. ![]() — гидрид кальция.
— гидрид кальция.
![]()
VI. Сравниваем Са по периоду с К и Sc; атомный радиус Са больше атомного радиуса Sc, но меньше атомного радиуса К. Поэтому он металличнее Sc, менее металличен, чем К. Сравниваем по группе, главной подгруппе с Mg и Sr; Атомный радиус Са больше атомного радиуса Mg, меньше атомного радиуса Sr, Са металличнее магния, менее металличен, чем Sr.
Неметаллический элемент
I. Хлор (Сl); АrCl = 35,5;
№ 17; III период; VII группа, главная подгруппа.
II. а) +17, 17 протонов; 18 нейтронов; 17 электронов,
б) ![]() р-элемент.
р-элемент.
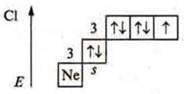
С.О. максимальная: +7; С.О. минимальная: -1.
Сl — неметаллический элемент.
III. Сl2O7 — оксид хлора(VII), кислотный оксид.
![]()
IV. НСlO4 — гидроксид, кислота:
![]()
V. Н+Сl- — водородное соединение, кислотный характер.
VI. По периоду сравниваем с S:
Cl — неметалличнее S, т.к. атомный радиус Cl меньше атомного радиуса S.
По группе главной подгруппе сравниваем с F и Вr.
Сl неметалличнее Вr, т.к. атомный радиус Сl меньше атомного радиуса Вr. По сравнению с F неметалличность Cl меньше, т. к. атомный радиус Сl больше атомного радиуса F.
III. Домашнее задание
Подготовиться к контрольной работе № 1: повторить § 1—5; отработать характеристику элемента на примере К; N.
IV. Закрепление
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
1. Атомные ядра были открыты:
A. Д. Менделеевым.
Б. Э. Резерфордом;
B. Дж. Томсоном.
Г. Д. Чедвигом.
2. Номер периода в Периодической системе определяется:
A. Зарядом ядра атома.
Б. Числом электронов в наружном слое атома.
B. Числом электронных слоев в атоме.
Г. Числом электронов в атоме.
3. Форму электронных орбиталей характеризует:
A. Главное квантовое число.
Б. Магнитное квантовое число.
B. Орбитальное квантовое число.
Г. Спиновое квантовое число.
4. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
A. S и CL.
Б. Be и В.
В. Кr и Хе.
Г. Мо и Se.
5. p-элементом является:
А. Скандий.
Б. Барий.
В. Мышьяк.
Г. Гелий.
6. Электронная конфигурация ...3d104s2 соответствует элементу:
A. Кальцию.
Б. Криптону.
B. Кадмию.
Г. Цинку.
7. Амфотерным гидроксидом является вещество, формула которого:
A. Zn(OH)2.
Б. Mg(OH)2.
В. Са(ОН)2.
Г. Сr(ОН)2.
8. Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Mg—Ca—Zn;
Б. Al—Mg—Са;
В. Sr—Rb—K;
Г. Ge—Si—Sb.
9. Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А. Э2O.
Б. Э2O3.
В. ЭO2.
Г. ЭO3.
10. Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают:
![]()
![]()
11. Установите соответствие. Элемент:
I. Алюминий. II. Калий. III. Селен. IV. Магний.
Электронная формула:
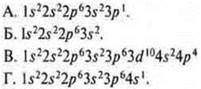
Формула высшего оксида:
1. Э2O. 2. Э2O3. 3.ЭС. 4. ЭO3.
Формула высшего гидроксида:
а. ЭОН. б. Э(ОН)2. в. Э(ОН)3. г. Н2ЭO4.
ЧАСТЬ Б. Задания со свободным ответом.
12. На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор — в порядке убывания окислительных свойств. Объясните ответ.
13. Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
14. Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15. Какие химические свойства характерны для высшего оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Ответы на задания для закрепления
ЧАСТЬ А.
1. Б; 2. В; 3. В; 4. В; 5. В; 6. Г; 7. А; 8. Б; 9. Б; 10. Г; 11. А - 2, в; Б - 3, б; В - 4, г; Г - 1, а.
ЧАСТЬ Б.
12. S — Р — As — Ge — убывают окислительные свойства, т.к. возрастает радиус атомов элементов, ослабевает связь электронов внешнего энергетического уровня с ядром атома, ослабевает способность атомов присоединять электроны — проявлять окислительные свойства.
13. А. В пределах периода (к концу периода) возрастает заряд ядра, количество электронов внешнего энергетического уровня, уменьшается атомный радиус, ослабевает металличность — способность атома отдавать электроны. Б. В пределах главной подгруппы (к концу группы, главной подгруппы) возрастают заряд ядра, количество энергетических уровней. Количество электронов внешнего энергетического уровня остается неизменным, усиливается металличность — способность атома отдавать электроны.
14. № 30. Zn (цинк). 1s22y22p63s23p64s23d10 — это d-элемент; на внешнем энергетическом уровне два электрона следовательно, это металлический элемент, проявляющий переходность, т.к. d-элемент.
ZnO — оксид цинка, амфотерный оксид;
ZN(OH)2 — гидроксид цинка, амфотерное основание.
15. III период, VI группа, главная подгруппа — сера, максимальное С.О. +6.
Электронная формула — 1s22s22p63s23p4, сера — неметаллический элемент. S+6O3 — высший оксид, оксид серы (VI), кислотный оксид.
а) взаимодействует с водой;
SO3 + Н2O = H2SO4 — серная кислота;
б) взаимодействует с растворимыми основаниями:
SO3 + КОН = KHSO4 — гидросульфат калия, кислая соль;
SO3 + 2КОН = K2SO4 + Н2O — сульфат калия, средняя соль;
в) взаимодействует с основными оксидами:
SO3 + СаО = CaSO4 — сульфат кальция.