Настольная книга учителя по химии 9 класс - поурочные разработки
Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева - Введение
Цели урока. Дать план общей характеристики химического элемента по его положению в Периодической системе и научить девятиклассников использовать его для составления характеристики элемента-металла. Повторить на основе этого сведения по курсу 8 класса о строении атома, о типах химической связи, о классификации неорганических веществ и их свойствах в свете ТЭД и ОВР, о генетической связи между классами соединений. Познакомить учащихся с решением задач на долю выхода продукта реакции.
Оборудование и реактивы. Li, Li2O, LiOH; СаСО3 и HNО3 для получения СО2; растворы: CuSО4, NH4Cl, НСl, фенолфталеина; пробирки, прибор для получения газов.
I. План характеристики химического элемента по его положению в Периодической системе
В отличие от плана, приведенного в учебнике, очевидно, будет логичным начать общую характеристику элемента именно с определения его «координат», т. е. положения в Периодической системе. Учащиеся очень часто этот пункт плана называют просто: «адрес химического элемента», т. е. указывают порядковый номер элемента, период (называется его тип: малый или большой) и группу (указывается тип подгруппы: главная или побочная). При выполнении этого пункта плана характеристики будет верным, если учитель введет и новые обозначения типа подгруппы: А — для главной и В (Б) — для побочной, что вызвано использованием такой символики в тестах и формулировках билетов выпускных экзаменов за курс основной и средней школы.
В учебнике приведен сокращенный вариант характеристики магния. Раскроем более подробно характеристику другого химического элемента-металла — лития.
II. Характеристика химического элемента лития по его положению в Периодической системе
1. Литий—это элемент 2 периода главной подгруппы I группы Периодической системы Д. И. Менделеева, элемент IA группы или (если учащиеся вспомнят курс восьмого класса) подгруппы щелочных металлов.
2. Строение атома лития можно отразить так:
![]()
Будет правильным, если здесь ученики охарактеризуют первую форму существования химического элемента — атомы.
Атомы лития будут проявлять сильные восстановительные свойства: легко отдадут свой единственный внешний электрон и получат в результате степень окисления (с. о.) + 1. Эти свойства атомов лития будут слабее выражены, чем у атомов натрия, что связано с увеличением радиусов атомов:
![]()
Учителю можно обратить внимание на проблему: почему же в электрохимическом ряду напряжений литий стоит впереди натрия. Все дело в том, что ряд напряжений характеризует не свойства атомов, а свойства металлов — простых веществ, т. е. второй формы существования химических элементов, для которой существенную роль играет не Raт, а параметры другого рода: энергия связи кристаллической решетки, стандартные электродные потенциалы и т. д.
Восстановительные свойства атомов лития выражены сильнее, чем у его соседа по периоду — бериллия, что связано и с числом внешних электронов, и с Raт.
3. Литий — простое вещество, представляет собой металл, а следовательно, имеет металлическую кристаллическую решетку и металлическую химическую связь (учитель повторяет с учениками определения этих двух понятий), образование которой можно отразить с помощью схемы:
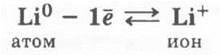
Учитель обращает внимание на то, как записывается заряд иона лития: не Li+1 (так указывают с. о.), a Li+.
По ходу этой характеристики повторяются также и общие физические свойства металлов, вытекающие из их кристаллического строения: электро- и теплопроводность, ковкость, пластичность, металлический блеск и т. д.
4. Литий образует оксид с формулой Li2О.
Учитель повторяет с учащимся состав и классификацию оксидов, в результате чего ученики сами формулируют, что Li20 — это солеобразующий, основный оксид. Это соединение образовано за счет ионной химической связи (почему?; учитель просит записать схему образования этой связи: 
![]() ) и, как и все основные оксиды, взаимодействует с кислотами, образуя соль и воду, и с кислотными оксидами, а также с водой, образуя щелочь. Ученики называют тип соответствующих реакций, записывают уравнения их, а реакцию с кислотами рассматривают также и в ионном виде.
) и, как и все основные оксиды, взаимодействует с кислотами, образуя соль и воду, и с кислотными оксидами, а также с водой, образуя щелочь. Ученики называют тип соответствующих реакций, записывают уравнения их, а реакцию с кислотами рассматривают также и в ионном виде.
5. Гидроксид лития имеет формулу LiOH. Это основание, щелочь.
Учитель повторяет с учащимися два блока сведений теоретического характера по материалу прошлого года: строение и свойства LiOH.
Строение. Учащиеся сами называют тип связи между Li+ и ОН- — ионный, говорят о том, что Li+ — простой ион, а ОН- — сложный. Тогда учитель просит определить тип связи между атомами кислорода и водорода в гидроксид-ионе. Ребята без труда называют его: ковалентная полярная связь. И тогда учитель подчеркивает, что наличие разных типов связи в одном веществе — аргумент в пользу утверждения о том, что деление химических связей на разные типы относительно, все связи имеют единую природу.
Химические свойства: взаимодействие с кислотами, кислотными оксидами и солями — рассматриваются в свете ТЭД и иллюстрируются уравнениями реакций в ионной и молекулярной формах (лучше именно в этом порядке).
6. Для характеристики водородного соединения (ее можно дать только в сильном классе) лучше использовать проблемную ситуацию: почему в горизонтальной графе «Летучие водородные соединения» в подгруппе щелочных металлов отсутствует общая формула?
Учащиеся резонно отвечают, что, это очевидно, так как эти металлы не образуют летучих водородных соединений. Учитель в ответ спрашивает: а какие соединения могут дать эти металлы с водородом? На это учащиеся довольно часто отвечают, что, наверное, бинарные соединения ионного типа с формулой М+Н-. Тогда учитель может завершить эту часть характеристики обоснованием вывода о том, что водород вполне законно занимает в Периодической системе двойственное положение: и в IA группе, и в VIIA группе.
III. Решение задач на нахождение доли выхода продукта реакции от теоретически возможного
Первая часть урока посвящена применению теоретических знаний за курс восьмого класса для описания свойств конкретного химического элемента. Это, так сказать, качественная сторона повторительно-обобщающего урока, вводного в курс химии элементов.
Количественная сторона такого урока может быть представлена расчетами, связанными с таким обобщающим понятием, как «доля выхода продукта реакции от теоретически возможного».
Учитель напоминает, что понятие «доля» имеет универсальный характер — она показывает, с какой частью от целого ведутся расчеты, — и напоминает разновидности этого понятия, с которыми оперировали учащиеся в прошлом году: доля элемента в соединении, массовая или объемная доля компонента в смеси веществ.
Теперь, продолжает учитель, познакомимся с долей выхода продукта реакции от теоретически возможного и предлагает решить задачу:
«Найдите объем углекислого газа (н. у.), который можно получить взаимодействием 250 г известняка, содержащего 20% примесей, с избытком азотной кислоты».
Учащиеся легко справляются с задачей, повторяя алгоритм решения расчетов по химическим уравнениям:
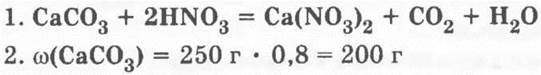

Учитель ставит проблему: можно ли на самом деле (на практике) получить рассчитанный теоретический объем? Ведь технология получения химической продукции часто оставляет желать лучшего. И демонстрирует взаимодействие кусочка мрамора с кислотой, а также собирание СО2 в колбу. Ученики без труда догадываются, что собранный объем продукта всегда будет меньше рассчитанного: часть его потеряется, пока учитель закроет прибор пробкой, часть улетучится, пока конец газоотводной трубки опустят в колбу, и т. д.
Учитель обобщает, что отношения объема (или массы) полученного продукта — практический выход к объему (или массе) рассчитанного теоретически и называется долей выхода — ωвых.или W:
![]()
Затем учитель просит найти объем СО2 для рассмотренной задачи, если выход его равен 75% от теоретически возможного:
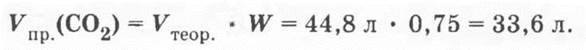
На дом предлагается обратная задача:
«При взаимодействии 800 мг 30%-ного раствора едкого натра (гидроксида натрия) с избытком раствора медного купороса (сульфата меди (И)) было получено 196 мг осадка. Каков его выход в процентах от теоретически возможного?»
IV. Генетический ряд металла
В заключение урока учащиеся вспоминают признаки генетического ряда металла:
1) один и тот же химический элемент-металл;
2) разные формы существования этого химического элемента: простое вещество и соединения — оксиды, основания, соли;
3) взаимопревращения веществ разных классов.
В итоге учащиеся записывают генетический ряд лития:

который учитель предлагает дома проиллюстрировать уравнениями реакций в ионной (там, где это имеет место) и молекулярной формах, а также разобрать все окислительно-восстановительные реакции.