Настольная книга учителя по химии 9 класс - поурочные разработки
Характеристика химического элемента-неметалла на основании его положения в Периодической системе Д. И. Менделеева - Введение
Цели урока. Научить девятиклассников давать общую характеристику элемента-неметалла. Повторить на основе этой характеристики основные сведения по курсу 8 класса о строении атома, о типах химической связи, о классификации неорганических веществ и их свойствах в свете ТЭД и ОВР, о генетической связи между классами веществ.
Оборудование и реактивы. Р(кр), Н2О, ВаСl2(р-р), лакмус (р-р); ложечка для сжигания веществ, колба.
I. Характеристика фосфора по его положению в Периодической системе
В учебнике приведен сокращенный вариант характеристики серы. Раскроем более подробно характеристику другого элемента-неметалла — фосфора Р.
1. Фосфор — это элемент 3 периода, главной подгруппы V группы Периодической системы Д. И. Менделеева, или VA группы.
2. Строение атома фосфора можно отразить с помощью такой записи:
![]()
Отсюда следует, что атомы фосфора, а также простые вещества, образованные этим элементом, могут проявлять как окислительные свойства (на вопрос учителя о том, с какими элементами и веществами, ученики без затруднений отвечают, что, разумеется, с металлами — атомами и простыми веществами, — которые всегда проявляют только восстановительные свойства), получая в результате с. о. -3 (ученики вспоминают, что такие соединения будут иметь общее название ![]() и приводят сами формулы фосфидов натрия, магния и алюминия), так и восстановительные свойства (с фтором, кислородом и другими более электроотрицательными элементами), получая при этом с. о., равную +3 и +5. Учитель предлагает написать формулы хлоридов фосфора (III) и (V) и разобрать схему образования химической связи для PСl3.
и приводят сами формулы фосфидов натрия, магния и алюминия), так и восстановительные свойства (с фтором, кислородом и другими более электроотрицательными элементами), получая при этом с. о., равную +3 и +5. Учитель предлагает написать формулы хлоридов фосфора (III) и (V) и разобрать схему образования химической связи для PСl3.
Фосфор более сильный окислитель, чем кремний, но менее сильный, чем сера, и, наоборот, — как восстановитель (почему?).
Фосфор более сильный восстановитель, чем азот, но менее сильный, чем мышьяк, и, наоборот, по отношению к окислительным свойствам (почему?).
3. Фосфор образует несколько простых веществ, т. е. этот элемент обладает свойством аллотропии.
Будет хорошо, если учитель повторит с учащимися, что такое аллотропия и какими причинами она вызывается (разным строением кристаллических решеток и разным числом атомов в молекулах), а также вспомнит, что аллотропия встречается, правда не столь часто, как у неметаллов, но и у металлов (например, у олова: α- и β-олово). Это дает возможность подчеркнуть, что деление простых элементов на металлы и неметаллы на основании сравнения свойств простых веществ, образованных элементами, относительно. Один и тот же элемент может существовать как в форме простого вещества — металла, так и в форме простого вещества — неметалла (например, аллотропные модификации олова или углерода — алмаз и графит, который уже обладает металлическим блеском и электропроводностью): все зависит от условий существования химического элемента. Известны даже металлический водород и газообразные пары щелочных металлов: Li2, Na2.
4. Фосфор образует высший оксид с формулой Р2O5. Учащиеся сами определяют характер этого оксида — кислотный и, соответственно, химические свойства: взаимодействие со щелочами, основными оксидами и водой. Записывают уравнения реакций (со щелочью также и в ионном виде).
Учитель указывает, что фосфор образует еще один оксид Р2O3, и просит ребят назвать его, а затем определить, какой из двух оксидов фосфора — Р2O3 или Р2O5 — соответствует фосфорной кислоте Н3РO4.
5. Высший гидроксид фосфора Н3РO4 является типичной кислотой. Учитель повторяет с учащимися понятие о гидроксидах, классификацию кислот и их общие химические свойства: взаимодействие с металлами, основными оксидами, основаниями и солями.
Проблемно решается вопрос о возможности протекания реакции фосфорной кислоты с металлами. Растворы Н3РO4 могут взаимодействовать только со щелочными металлами, так как только фосфаты этих металлов растворимы, но они восстанавливают в первую очередь катионы Н+ не кислоты, а воды. Поэтому уравнения реакции для взаимодействия Н3РO4 с металлами не пишут. Реакции фосфорной кислоты с оксидами при обычных условиях идут только с оксидами щелочных металлов, ибо только их фосфаты в воде растворимы. На поверхности оксидов остальных металлов образуется пленка нерастворимого фосфата, и взаимодействие прекращается, так как не соблюдается важнейшее условие протекания химической реакции: соприкосновение реагирующих веществ.
Возможные уравнения реакций: например с Na2O, КОН, Na2CO3, ВаСl2, — учащиеся записывают в двух формах (молекулярной и ионной). Мы рекомендуем при этом и для ионных уравнений использовать молекулярную формулу H3PO4 как слабого (точнее, среднего) электролита.
6. Фосфор образует летучее водородное соединение фосфин РН3.
Здесь будет уместно повторить возникновение ковалентной связи для фосфина и на примере этого соединения использовать уникальную возможность показать образование ковалентной неполярной связи между атомами разных элементов-неметаллов, но с одинаковой электроотрицательностью (ЭО): ЭО(Р) = ЭО(Н).
II. Генетический ряд неметалла
Здесь, как и на предыдущем уроке, учащиеся вспоминают признаки генетического ряда неметалла:
1) один и тот же химический элемент-неметалл;
2) разные формы существования этого элемента: простые вещества (аллотропия) и соединения: оксиды, основания, соли, водородные соединения;
3) взаимопревращения веществ разных классов.
По итогам этого обобщения учащиеся записывают генетический ряд фосфора:
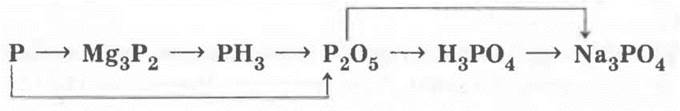
который учитель предлагает проиллюстрировать уравнениями реакций в ионной (там, где это имеет место) и молекулярной формах, а также разобрать все окислительно-восстановительные реакции.
Учитель может провести демонстрацию: горение помещенного в ложечку фосфора в колбе, растворение полученного оксида в воде, испытание полученного раствора лакмусом и образование осадка при приливании к раствору нескольких капель раствора, например ВаСl2.
III. Закономерности изменения свойств атомов, простых веществ и соединений элементов в Периодической системе
Эту часть урока учитель проводит в форме комментированного чтения таблицы 1 учебника. Рассмотрение (повторение) закономерностей можно провести и в форме заполнения выданной на каждую парту или каждому ученику таблицы, в которой указаны способы существования химических элементов и их свойства и требуется заполнить графы изменения свойств этих способов существования для периодов и групп. Такая форма организации ближе к тестовому контролю, тогда как первая — к беседе.