Настольная книга учителя по химии 9 класс - поурочные разработки
Общая характеристика неметаллов - Неметаллы
Цели урока. Используя антитезу (противоположность, противопоставление) с металлами, рассмотреть положение неметаллов в Периодической системе и особенности строения их атомов, вспомнить ряд электроотрицательности. Повторить понятие аллотропии и кристаллическое строение неметаллов, а следовательно, рассмотреть и их физические свойства. Показать роль неметаллов в неживой и живой природе. Дать понятие о микро- и макроэлементах, раскрыть их роль в жизнедеятельности организмов.
Оборудование и реактивы. Образцы неметаллов — простых веществ Н2, O2, Сl2 (в пробирках с пробками); Вr2 (в ампуле); S, I2, Р (кр.), активированный уголь, пьезозажигалка, йодкрахмальная бумажка, ватный тампон с ниткой, горелка, пробирки, аэрозольные упаковки с бытовыми ядохимикатами («Дихлофос», «Хлорофос» и т. д.), образцы микроудобрений, упаковки витаминов.
I. Положение неметаллов в Периодической системе Д. И. Менделеева и строение их атомов. Электроотрицательность (ЭО)
Эту вводную часть урока учитель может провести в форме беседы, противопоставляя уже изученный учащимися класс металлов классу неметаллов. Здесь следует обратить внимание на то, что понятия «металлы» и «неметаллы» применяют к разным объектам: и к химическим элементам, и к химическим веществам.
Понимая под химическим элементом более общее, родовое понятие, которое может иметь три формы существования, учитель с учащимися повторяет особенности каждой из этих форм: свободных атомов (различия между металлами и неметаллами по таким характеристикам, как радиус, электроотрицательность атомов, способность их к окислению и восстановлению, и т. д.), простых веществ (различия в строении кристаллических решеток, физических и химических свойствах) и соединений элементов (различия в кислотно-основных свойствах оксидов, гидроксидов и т. д.).
Для атомов неметаллов, по сравнению с атомами металлов, характерны:
• более маленький радиус;
• четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов — тенденция к приему недостающих до 8 электронов, т. е. окислительные свойства. Учителю важно подчеркнуть, что обе характеристики важны для проявления этой особенности. Например, атом бора В содержит на внешнем уровне 3 электрона, но относится к неметаллам из-за небольшого радиуса, и наоборот, атомы висмута Bi и теллура Те содержат на внешнем уровне соответственно 5 и б электронов, но относятся к металлам, так как имеют большой радиус атомов.
Учитель просит учеников вспомнить условную границу между металлами и неметаллами в Периодической таблице, проходящую по диагонали В — At. На применяемой в школьной практике короткопериодной таблице эта диагональ предстает для учащихся в виде ступенчатой ломаной линии, поэтому, наверное, будет логичной демонстрация этой диагонали на длиннопериодном варианте таблицы.
Если уже используется короткопериодный вариант ее, то следует еще раз подчеркнуть, что только из металлов состоят четные ряды больших периодов. В итоге из 110 элементов к неметаллам относятся 22 элемента. И этот вывод следует уточнить в том плане, что более правильным будет, если из 22 элементов — неметаллов исключить 6 элементов — благородных или инертных газов, которые чисто условно, только на основании физических свойств простых веществ, могут быть отнесены к неметаллам. Более верным будет все химические элементы на основании различий в строении их атомов, образуемых ими простых и сложных веществ делить на три класса:
1. Металлы — 88 элементов из 110.
2. Неметаллы — 16 элементов.
3. Благородные или инертные газы — 6 элементов.
Качественной характеристикой атомов неметаллов, т. е.
своеобразной мерой неметалличности их, может служить электроотрицательность, т. е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Знакомый учащимся ряд ЭО не всегда может рассматриваться аналогом электрохимического ряда напряжений металлов, так как ряд ЭО характеризует свойства атомов, а ряд напряжений — свойства простых веществ — металлов.
II. Неметаллы - простые вещества. Аллотропия
Если металлы — простые вещества образованы за счет металлической связи, то для неметаллов — простых веществ характерна ковалентная неполярная химическая связь.
В отличие от металлов неметаллы — простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
• газы — Н2, О2, О3, N2, F2, Cl2;
• жидкость — Вr2;
• твердые вещества — модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный — у фосфора, бурый — у брома, желтый — у серы, желто- зеленый — у хлора, фиолетовый — у паров йода и т. д.
Элементы-неметаллы более способны по сравнению с металлами к аллотропии. Учителю предоставляется хорошая возможность повторить атомные и молекулярные кристаллические решетки неметаллов при рассмотрении причин этого явления: разного состава молекул аллотропных модификаций одного элемента (на примере кислорода и озона — молекулярные кристаллические решетки) и разного строения кристаллических решеток у модификаций фосфора (атомная — у красного фосфора и молекулярная — у белого фосфора).
Учитель может продемонстрировать свойства озона на очень простом опыте: сделать несколько включений пьезо- или электрозажигалки вблизи влажной йодкрахмальной бумажки. Последняя посинеет от образующегося под действием озона иода. Сравнение свойств озона и кислорода можно оформить в виде таблицы (табл. 2).
Таблица 2. Сравнение аллотропных модификаций кислорода
|
Признаки сравнения |
Кислород О2 |
Озон О3 |
|
|
Общие признаки |
|||
|
1. Физические свойства |
Газы при обычных условиях |
||
|
2. Принадлежность к определенному классу веществ |
Простые вещества, которые образованы одним и тем же элементом — кислородом, т. е. являются его аллотропными модификациями |
||
|
3. Химические свойства |
Сильные окислители |
||
|
Признаки различия |
|||
|
1. Физические свойства |
Газ без цвета и запаха, жидкий — имеет голубой цвет, твердый — синие кристаллы. Мало растворим в воде. Не задерживает ультрафиолетовые лучи |
Синий газ с резким запахом. В воде растворяется в 10 раз лучше кислорода. Задерживает ультрафиолетовые лучи |
|
|
2. Биологические свойства |
Не ядовит. Не бактериоциден. Вещество, необходимое для дыхания аэробных организмов |
Сильно раздражает глаза и дыхательные пути. Ядовит в больших концентрациях. Бактериоциден |
|
|
3. Химические свойства |
Сильный окислитель. Взаимодействует со всеми металлами, кроме платиновых, и неметаллами, кроме галогенов (их соединения получают косвенно). Реагирует со сложными веществами, образуя, как правило, оксиды тех элементов, из которых построено сложное вещество |
Еще более сильный окислитель, чем кислород, поэтому реакции с участием озона протекают с большими скоростями. Более энергично окисляет почти все простые вещества (в том числе Аи и Pt) и многие сложные вещества |
|
|
4. Нахождение в природе |
В воздухе: 21% — по объему и 23,15% — по массе. В растворенном виде содержится в воде, входит в состав почвы |
Содержание в воздухе: летом — до 7 · 10-9 % (по объему), зимой — до 2 · 10-10 %. В атмосфере максимальная концентрация на высоте 20—25 км, где озон образует слой, защищающий Землю от УФ-излучения |
|
|
5. Получение |
Фракционной перегонкой жидкого воздуха и электролизом воды в присутствии NaOH или H2SO4 |
Под действием электрических разрядов или УФ-излучения на кислород воздуха |
|
|
6. Применение |
Вещество, необходимое для дыхания и горения |
Обеззараживание воды, отбеливание тканей, дезодорирование продуктов питания |
|
Рассмотрение аллотропии кислорода позволяет вскрыть первую причину этого явления — переход количества в качество.
Вторая причина — разное строение кристаллических решеток — может быть показана на примере аллотропии фосфора.
Учитель получает белый фосфор из красного (см. пособие для 8 класса) и указывает, что палитра модификаций фосфора не ограничивается только этими двумя разновидностями. Атомы фосфора могут образовать три ковалентные связи, как и атомы азота. Но в двухатомной молекуле азота каждый атом азота связан с соседним прочной тройной связью, тогда как в модификациях фосфора атомы связаны попарно лишь одной связью. Если один атом фосфора присоединит к себе подобным образом три других, то может образоваться простейшая молекула из четырех атомов, каждый из которых связан ковалентной связью с тремя остальными. Форма молекулы — тетраэдр (рис. 16, а). Из таких молекул состоит белый фосфор. Его кристаллическая решетка, таким образом, молекулярная, она слагается из молекул, слабо связанных межмолекулярными силами. Поэтому белый фосфор, подобно другим веществам с молекулярной решеткой, легкоплавок и летуч. В воде он почти нерастворим, но хорошо растворяется во многих органических растворителях. Белый фосфор сильно ядовит.
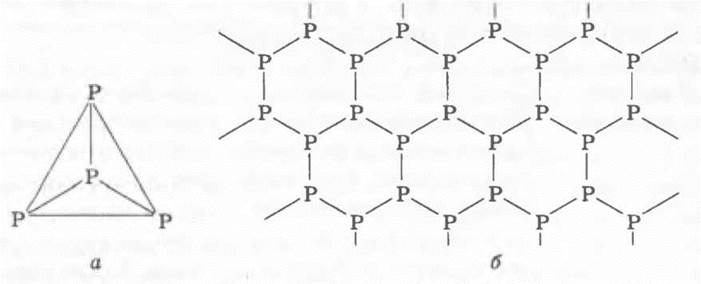
Рис. 16. Схемы строения: молекулы белого (а) и кристаллической решетки черного (б) фосфора
При умеренном нагревании под очень высоким давлением (превышающим более чем в 1200 раз атмосферное) белый фосфор переходит в черный, который обладает атомной слоистой кристаллической решеткой (рис. 16, б). Черный фосфор характеризуется наименьшей реакционной способностью по сравнению с другими разновидностями фосфора.
На свету или при слабом нагревании без доступа воздуха белый фосфор превращается в порошок красно-бурого цвета (красный фосфор). Красный фосфор нелетуч и нерастворим в воде и органических растворителях, не ядовит.
При сильном нагревании без доступа воздуха красный фосфор вновь превращается в белый фосфор. Учитель напоминает ученикам, что это явление можно наблюдать, слегка чиркнув в темноте спичкой о коробок так, чтобы она не зажглась. На мгновение головка спички оставит на коробке светящийся след — это светится белый фосфор.
Сравнение свойств белого и красного фосфора учитель может также оформить в ходе беседы в форме таблицы 3.
Таблица 3. Сравнение аллотропных модификаций фосфора
|
Признаки сравнения |
Фосфор красный |
Фосфор белый |
|
Общие признаки |
||
|
1. Физические свойства |
Твердые, кристаллические вещества |
|
|
2. Принадлежность к определенному классу веществ |
Простые вещества, которые образованы одним и тем же элементом — фосфором, т. е. являются его аллотропными модификациями |
|
|
3. Химические свойства |
Неметаллы, взаимодействуют со многими простыми веществами (кислородом, галогенами, серой, металлами) и сложными веществами-окислителями (бертолетовой солью, азотной кислотой) |
|
|
Признаки различия |
||
|
1. Строение |
Имеет атомную кристаллическую решетку |
Имеет молекулярную кристаллическую решетку и формулу Р4 |
|
2. Свойства |
Порошок красно-бурого цвета, не ядовит. Не растворяется ни в воде, ни в сероуглероде. Не светится в темноте. Загорается лишь при поджигании |
Белое воскообразное вещество. Очень ядовит. Не растворяется в воде, но хорошо растворяется в сероуглероде. Светится в темноте. В порошке самовоспламеняется. Поэтому его хранят под водой |
|
Реакции с красным фосфором идут менее энергично, чем с фосфором белым |
||
|
3. Получение |
Нагревание белого фосфора без доступа воздуха в течение нескольких часов при 375— 400 °С |
Прокаливанием смеси фосфоритов, песка и угля: 2Са3(РО4)2 + 10С + 6SiО2= 6CaSiО3 + Р4 + 10CO |
|
4. Применение |
Для производства спичек и фосфорных удобрений |
Для производства фосфорных кислот, в военном деле (напалм, дымовые шашки, самовоспламеняющиеся смеси), для получения ядохимикатов |
III. Химические элементы в живой клетке
Второй урок учитель посвящает рассмотрению химической организации клетки, особо останавливаясь на роли микроэлементов, так как значение макроэлементов дается достаточно подробно при изучении соответствующих элементов.
Вначале учитель дает классификацию химических элементов по их содержанию в живой клетке (схема 2).
Схема 2. Классификация химических элементов по их содержанию в живых клетках
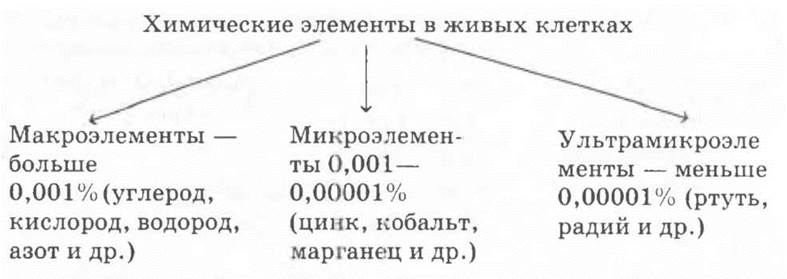
В составе живого вещества найдено 74 элемента Периодической системы. Десять элементов: С, О, Н, N, S, Р, Са, Mg, К, Na — составляют 99,9% живого субстрата. Их называют макроэлементами. Таким образом, подчеркивает учитель, на долю остальных элементов приходится около 0,1%. Это микро- и ультрамикроэлементы. Условно к микроэлементам относят такие элементы, которые содержатся в растениях, тканях животных и человека от 0,001 до 0,00001%. Элементы, содержащиеся в указанных объектах в еще меньших количествах, называют ультрамикроэлементами. Провести резкую границу между микро- и ультрамикроэлементами нельзя, так как в различных растительных и животных организмах их содержание может резко колебаться. Так, элемент бор по содержанию в растениях (10-4 %) можно отнести к микроэлементам, а по содержанию в организме животных (10-6 %) — к ультрамикроэлементам.
IV. Микроэлементы в живой клетке
В живых организмах содержится около 30 микроэлементов. Они входят в состав ферментов, гормонов, витаминов и других жизненно важных соединений.
Ферменты — это катализаторы биологического происхождения, которые ускоряют биохимические реакции, а активность ферментов регулируется микроэлементами, хотя известны случаи, когда активация ферментов возможна как микроэлементами, так и макроэлементами. Ниже приведены примеры ферментов, в которых как микроэлементы, так и макроэлементы выполняют сходные функции.
|
Фермент |
Микроэлементы и макроэлементы (в форме ионов), активирующие фермент |
|
Карбоксилаза |
Mn2+, Со2+, Cu2+, Fe2+, Са2+, Zn2+ |
|
Полипептидаза |
Zn2+, Со2+ |
|
Аминопептидаза |
Mg2+, Мn2+ |
|
Лецитиназа |
Са2+, Mg2+, Со2+, Zn2+, Мn2+ |
|
Аргиназа |
Со2+, Mn2+, Ni2+, Fe2+ |
Экспериментально доказано, что микроэлементы необходимы для многих важнейших биохимических процессов. Их недостаток замедляет эти процессы и даже останавливает их. Для белкового, углеводного и жирового обмена веществ необходимы Mo, Fe, V, Со, W, В, Mn, Zn; в синтезе белков участвуют Mg, Mn, Fe, Со, Сu, Ni, Сr; в кроветворении — Со, Сu, Мn, Ni, Zn; в дыхании — Mg, Fe, Сu, Zn, Mn, Со. Поэтому микроэлементы нашли широкое практическое применение в качестве микроудобрений для полевых культур, подкормок в животноводстве, птицеводстве, рыбоводстве.
Борные удобрения применяют больше всего под сахарную свеклу, кормовые культуры, лен, хлопчатник. Молибден важен при выращивании бобовых культур, поскольку он необходим для деятельности клубеньковых бактерий, связывающих атмосферный азот. В удобрениях, содержащих медь, чаще всего нуждаются многие сельскохозяйственные культуры, выращиваемые на осушенных торфяно-болотных почвах, где мало меди или она прочно связана, а также на супесчаных и песчаных почвах. Цинковые удобрения полезны во многих регионах России и смежных государств, они могут быть эффективны при выращивании кукурузы, сахарной свеклы, хлопчатника, овощных культур. В почвах с нейтральной или слабощелочной реакцией мало усвояемого растениями марганца, который при такой реакции почв легко превращается в трудно-растворимый пиролюзит МnO2, в карбонаты или фосфаты, поэтому в такие почвы нередко вносят марганцовые удобрения. Разработаны кобальтовые удобрения, йодные, а также комплексные микроудобрения, содержащие несколько элементов. (См. Соросовский образовательный журнал, № 1/ 1998, статью Д. С. Орлова «Микроэлементы в почвах и живых организмах».)
V. Биологическая роль микроэлементов
Мощное воздействие микроэлементов на физиологические процессы объясняется тем, что они входят в состав так называемых акцессорных веществ: дыхательных пигментов, витаминов, гормонов, ферментов, а также коферментов, участвующих в регуляции жизненных процессов. Микроэлементы влияют на направленность действия ферментов и их активность. Это дало основание известному российскому ученому-агрохимику А. В. Петербургскому назвать микроэлементы катализаторами катализаторов.
Микроэлементы требуются для всех организмов лишь в оптимальных количествах. Полное их отсутствие в питании так же, как и их избыток, вызывает заболевания и гибель живых организмов от болезней, связанных с резким нарушением обмена веществ.
На этом этапе урока учитель предлагает учащимся обобщить сведения о биологической роли микроэлементов.
Как уже известно, микроэлементы участвуют в таких важнейших биохимических процессах, как дыхание (медь, цинк, марганец, кобальт), фотосинтез (марганец, медь), синтез белков (марганец, кобальт, медь, никель, хром), кроветворение (кобальт, медь, марганец, никель, цинк), белковый, углеводный и жировой обмен веществ (молибден, ванадий, кобальт, вольфрам, марганец, цинк), синтез гумуса (медь).
Живые организмы весьма требовательны к определенной концентрации микроэлементов в среде, к набору, соотношению и формам их соединений. Недостаток или избыток микроэлементов в почве одинаково вредно сказывается на развитии организмов, вызывая эндемические заболевания растений, животных, человека. Например, с недостатком меди связаны суховершинность плодовых деревьев, атаксия (нарушение координации движений) овец и крупного рогатого скота; избыток меди и цинка приводит к заболеванию животных анемией (малокровием). При недостатке цинка развиваются розеточная болезнь плодовых деревьев, пятнистость листьев у цитрусовых, побеление верхушки у кукурузы, прекращение роста, паракератоз (утолщение кожи) животных. При сильном борном голодании у растений не образуются цветки, сахарная свекла заболевает серцевинной и сухой гнилью, а лен — бактериозом. В случае молибденовой недостаточности у томатов наблюдаются пятнистость листьев и их свертывание, а у цветной капусты — нитевидность листьев. Недостаток марганца приводит к заболеванию хлорозом табака, кукурузы, хлопчатника, бобовых, овса, сахарной свеклы. При высоком содержании бора в почвах появляются низкорослые растения распластанной или кустистой формы, а стронция — к образованию уродливых форм растений.
Давно известна уникальная способность бобовых растений связывать молекулярный азот из атмосферного воздуха. Этот процесс протекает под строгим контролем трех металлов: молибдена, кобальта и ванадия, которые стимулируют эту фиксацию, а в конечном итоге и синтез белка. Предполагают и участие во всех этих явлениях еще одного металла — титана. Стронций в малой дозе способен повышать содержание крахмала в клубнях картофеля.
Растения извлекают из почвы микроэлементы выборочно: кукуруза — золото и цинк, полынь — марганец, красный мухомор — ванадий, фиалки и табак — цинк, хлопчатник — кобальт. Результатом избирательного поглощения микроэлементов из почвы является их неодинаковое накопление в самом растении. Например, чечевица интенсивно концентрирует титан и мышьяк, гречиха — бор, стронций, молибден; чай — кобальт, медь, фтор; кукуруза — медь, селен, олово, цинк; свекла — цинк, марганец, фтор, медь, бор; все бобовые — ванадий и молибден.
Итак, микроэлементы поступают в растения из почвы, а животные и человек получают их из пищи. Как чувствуют себя живые организмы, получающие микроэлементы из почв с различным уровнем их содержания (при дефиците или избытке)? Избыток в почве даже полезных для растений веществ может оказаться ядом для них и микроорганизмов. (См. Соросовский образовательный журнал, № 12/1998, статью Н. А. Протасовой «Микроэлементы: биологическая роль».)
Многие элементы, обычно содержащиеся в малых количествах, нередко относят к токсичным элементам, например Hg, Pb, Cd. Несмотря на это, нужно подчеркнуть, что и другие микроэлементы, когда их слишком много, могут стать токсичными (так же, между прочим, как и макроэлементы), а токсичные элементы при очень малых концентрациях не оказывают вредного воздействия на растения и животный мир. Иными словами, если быть точным, нет токсичных элементов, а есть их токсичные концентрации.
Чтобы связать материал урока с жизнью, учитель раздает учащимся различные упаковки известных марок витаминов («Дуовит», «Витрум», «Мегавит», «Юникап» и др.) и просит ознакомиться с составом этих препаратов и рассказать о роли микро- и макроэлементов, входящих в них.