Настольная книга учителя по химии 9 класс - поурочные разработки
Общая характеристика галогенов - Неметаллы
Цели урока. Дать общую сравнительную характеристику галогенов в свете трех форм существования элементов: свободных атомов, простых веществ и важнейших соединений их, — в плане общего, особенного и единичного. Повторить, обобщить, закрепить и конкретизировать на материале химии галогенов такие важнейшие химические понятия, как «химическая связь», «кристаллические решетки», «окисление и восстановление», «скорость химической реакции», «химическое равновесие» и т. д.
Оборудование и реактивы. Образцы галогенов — простых веществ, Na, Аl (в порошке), алюминиевая фольга, кусочек Sb, хлорная и бромная вода, растворы КВr или NaBr, KI или Nal,AgNO3, СаСl2, MnO2, НСl (конц.), этиловый спирт, ступка с пестиком, пипетка, фарфоровая чашечка, штатив, горелка, кристаллизатор с песком, пилочка для ногтей, колбы на 50—100 мл, кружки фильтровальной бумаги, ватные тампоны, марлевый мешочек с карболеном. Образцы природных минералов (галит, сильвин, сильвинит, плавиковый шпат, криолит), изделий с тефлоном, фторсодержащих зубных паст, хлор- и бромсодержащих материалов и лекарств.
I. Строение атомов галогенов
Учащиеся сами называют положение галогенов в Периодической системе и, исходя из этого, указывают, что атомы этих элементов содержат на внешнем энергетическом уровне семь электронов и до его завершения им недостает только одного электрона, поэтому галогены проявляют яркие окислительные свойства. В подгруппе с увеличением порядкового номера, подчеркивают учащиеся, эти свойства уменьшаются в связи с увеличением радиуса атомов: от фтора к астату — и соответственно возрастают восстановительные свойства их. Аналогично, соглашается учитель, уменьшается и значение относительной ЭО галогенов. Как наиболее электроотрицательный элемент, фтор в соединениях с другими элементами проявляет постоянную степень окисления —1. Остальные галогены могут проявлять как эту степень окисления в соединениях с металлами, водородом и менее электроотрицательными элементами, так и положительные нечетные степени окисления от +1 до +7 в соединениях с более электроотрицательными элементами: кислородом, фтором.
II. Простые вещества и их свойства
Характеризуя простые вещества — галогены, учащиеся используют основные теоретические сведения о типах химической связи, указывая, что в двухатомных молекулах галогенов атомы связаны ковалентной неполярной связью 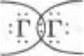 или Г — Г; о кристаллическом строении вещества, указывая, что галогены имеют молекулярную кристаллическую решетку, а следовательно, при обычных условиях F2 и Сl2 — газы, Вr2 — бурая жидкость, а I2 — твердое кристаллическое вещество, способное к возгонке (демонстрация). Указывают, что в ряду F2, Сl2,Вr2, I2 — плотность простых веществ растет, а интенсивность окраски увеличивается. Следовательно, подчеркивает учитель, в изменении свойств атомов и простых веществ — галогенов проявляется одинаковая закономерность: с увеличением порядкового номера неметаллические свойства ослабевают, а металлические — усиливаются.
или Г — Г; о кристаллическом строении вещества, указывая, что галогены имеют молекулярную кристаллическую решетку, а следовательно, при обычных условиях F2 и Сl2 — газы, Вr2 — бурая жидкость, а I2 — твердое кристаллическое вещество, способное к возгонке (демонстрация). Указывают, что в ряду F2, Сl2,Вr2, I2 — плотность простых веществ растет, а интенсивность окраски увеличивается. Следовательно, подчеркивает учитель, в изменении свойств атомов и простых веществ — галогенов проявляется одинаковая закономерность: с увеличением порядкового номера неметаллические свойства ослабевают, а металлические — усиливаются.
Учитель просит учащихся объяснить этимологию названия подгруппы («рождающие соли») и переходит к рассмотрению химических свойств галогенов.
III. Химические свойства галогенов Взаимодействие галогенов с металлами
1. Взаимодействие йода с натрием. В фарфоровую ступку помещается несколько кристалликов йода, которые втираются пестиком во внутреннюю поверхность стенки ступки. Затем в нее помещается два кусочка натрия величиной с половину спичечной головки, которые растираются на поверхности ступки со следами йода. Из-под пестика раздаются звуки взрыва и появляются пламя и фиолетовые пары йода. Происходит реакция:
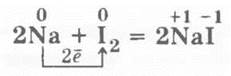
2. Взаимодействие алюминия с йодом позволяет повторить катализаторы и катализ. В фарфоровую чашечку помещают смесь хорошо перемешанных порошков алюминия и йода (1:15 по массе), затем туда капают 1—3 капли воды с помощью пипетки — происходит вспышка, появляются фиолетовые пары йода, так как реакция эндотермическая и часть кристаллов йода возгоняется:
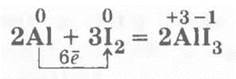
3. Взаимодействие алюминия с бромом (проводят под тягой). В пробирку, закрепленную в лапке штатива, приливают 1—2 мл жидкого брома, куда опускают свернутый в рыхлый шарик кусочек алюминиевой фольги. Под пробирку на всякий случай помещают кристаллизатор с песком. Через некоторое время в бурой жидкости возникает алая искорка, которая постепенно разгорается, а в пробирке появляются густые бурые клубы парообразного брома:
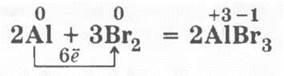
4. Взаимодействие сурьмы с хлором. В колбу, заполненную хлором в небольшой концентрации, сверху с помощью пилочки для ногтей из маникюрного набора или небольшого напильника сшелушивают небольшие чешуйки сурьмы с кусочка, который учитель держит над горлышком колбы. Если концентрация хлора небольшая, в колбе образуется ряд красивых белых шелковых нитей, расположенных параллельно друг другу — траекторий падающих чешуек. Если же концентрация хлора будет достаточно высокой, то чешуйки сурьмы вспыхивают красивыми яркими звездами, а колба заполняется густым белым дымом три- и пентахлоридов сурьмы:
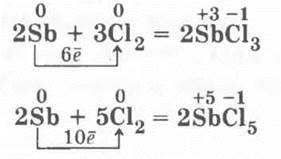
В каждом случае рассматриваются окислительно-восстановительные процессы. Учитель записывает уравнения реакции взаимодействия, например, щелочных металлов с галогенами, используя обобщенные символы:
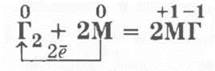
Учащиеся кратко характеризуют продукты реакции (как правило, это реакция горения, поэтому уместно вспомнить экзотермические реакции и их частный случай — реакции горения), определяют тип связи в них и тип кристаллической решетки, а следовательно, и некоторые физические свойства галогенидов как веществ с ионной связью и ионной кристаллической решеткой.
Здесь учителю будет уместно напомнить учащимся, что при реакциях металлов побочных подгрупп (переходных металлов) с галогенами образуются галогениды с большой степенью окисления металла, например:
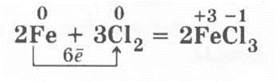
но 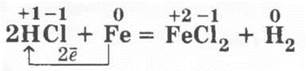
Взаимодействие галогенов с водородом
Галогены взаимодействуют водородом, образуя галогеноводороды:
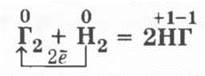
Ученики указывают для продукта реакции тип связи (ковалентная полярная) и тип решетки (молекулярная). Сравнение скорости химических реакций разных галогенов с водородом позволяет повторить зависимость ее от природы реагирующих веществ. Так, фтор имеет настолько большую скорость реакции, что взаимодействует с водородом со взрывом даже в темноте. Реакция хлора с водородом при обычных условиях идет медленно и лишь при поджигании или освещении скорость ее возрастает во много раз (происходит взрыв). Еще медленнее взаимодействуют с водородом бром и йод, причем последняя реакция приобретает уже эндотермический характер:
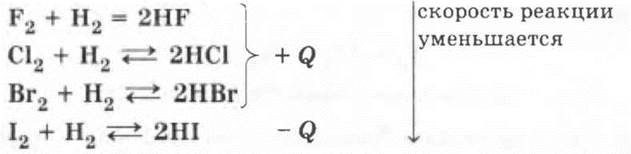
Только фтор взаимодействует с водородом необратимо, остальные галогены в зависимости от условий могут давать и обратимую реакцию:
![]()
Рассмотрение ее позволит повторить понятие о химическом равновесии и способах его смещения (принцип Лe Шателье).
Взаимодействие галогенов с водой
Галогены взаимодействуют с водой согласно обобщенному уравнению:
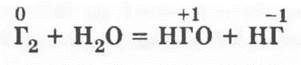
Для фтора же учитель подчеркивает проявление единичного — вода во фторе горит:

Рассматривается окислительно-восстановительный процесс и подчеркивается, что, может быть, единственный раз в своей химической истории кислород является не причиной, а следствием горения, выступая в непривычной для него роли восстановителя.
В числе продуктов горения могут быть также фториды кислорода 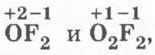 в которых кислород проявляет необычные для него степени окисления +1 и +2.
в которых кислород проявляет необычные для него степени окисления +1 и +2.
«Ряд активности» галогенов
Очевидно, такое название правомочно для характеристики способности одних галогенов к вытеснению других из растворов их соединений, так как, подобно ряду напряжений (активности) металлов, характеризует свойства не атомов галогенов, а свойства простых веществ. Этот ряд можно записать так:
![]()
окислительные свойства уменьшаются
Так, хлор вытесняет бром и йод (но не фтор), а бром в состоянии вытеснить только йод из растворов соответствующих солей:
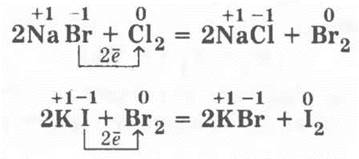
На вопрос учителя, почему для этих процессов не берется фтор, учащиеся легко отвечают, что причина заключается в том, что он взаимодействует с водой. В этом случае будет уместна аналогия со щелочными металлами, которые также взаимодействуют с водой, а потому не используются для вытеснения менее активных металлов из растворов их солей.
Демонстрацию последовательного вытеснения галогенов из растворов их солей можно провести, используя стандартный заводской прибор. Однако он отсутствует во многих школах.
Можно использовать для этой цели хлорную и бромную воду. В этом случае проводится лабораторная работа.
На белую фильтровальную бумагу, помещенную на стеклянную или пластиковую планшетку, капают из пипеток по одной капле растворов NaBr и KI. Затем к первой капле добавляют каплю хлорной воды, а ко второй — бромной воды и через некоторое время к пятну второй капли капают раствор крахмального клейстера. Появление бурой окраски в первом случае и посинение — во втором наглядно покажут «ряд активности» галогенов в работе.
Для демонстрации учитель может использовать простейший самодельный прибор. Основой его служит демонстрационная пробирка — реактор, на который маркером наносятся две метки (пробирка как бы делится на три равные части). На дно пробирки помещают немного (со спичечную головку) оксида марганца (IV) и 2—3 капли дымящейся НСl. Против нижней метки помещают с помощью пинцета или стеклянной палочки рыхлый ватный тампон, предварительно смоченный свежеприготовленным концентрированным раствором бромида натрия или калия и слегка подсушенный над пламенем спиртовки (тампон должен быть обязательно немного влажным).
Выше, около второй метки, помещают аналогично приготовленный тампон, смоченный концентрированным раствором иодидов натрия или калия.
Пробирку закрепляют в штативе и смесь, находящуюся на дне, нагревают.
Начинает выделяться хлор, который, проходя через первый тампон, вытесняет бром (бурое окрашивание). Бром, проходя через второй тампон, вытесняет йод (темное окрашивание). Если подогреть пробирку выше второго тампона, можно наблюдать фиолетовые пары иода. Для поглощения избытка галогенов в пробирку помещают марлевый мешочек с активированным углем.
IV. Основные соединения галогенов
Соли — галогениды характеризовались при рассмотрении взаимодействия галогенов с металлами (тип связи, тип решетки). В качестве представителей называются природные соединения:
1) NaCl — галит;
2) КСl — сильвин и как синтез названий этих минералов;
3) КСl · NaCl — сильвинит.
Учащиеся вспоминают из курса 8 класса красочный рассказ о поваренной соли.
Галогеноводороды -  или
или 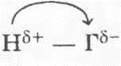 - это едкие газы с резким запахом, хорошо растворимы в воде. Растворы их представляют собой бескислородные кислоты.
- это едкие газы с резким запахом, хорошо растворимы в воде. Растворы их представляют собой бескислородные кислоты.
Сравнительная характеристика галогеноводородов позволяет рассмотреть водородные соединения элементов одной подгруппы. В ряду HF — НСl — HBr — HI уменьшается прочность молекул, так как увеличивается радиус атома галогена, уменьшается его ЭО. Отсюда сила кислот, образуемых при растворении галогеноводородов в воде, увеличивается: HF — кислота средней силы, остальные относятся к сильным кислотам. Наибольшего значения степень электролитической диссоциации достигает у HI. На этом примере учитель демонстрирует зависимость степени электролитической диссоциации от природы электролита.
Качественная реакция на галогенид-ионы. Учащиеся, анализируя таблицу растворимости, самостоятельно приходят к выводу, что качественной реакцией на галогенид-ионы (кроме F- — почему?) является их взаимодействие с ионом серебра (AgNO3):
![]()
Галогениды серебра — осадки разных оттенков белого и желтого цветов. По ним можно распознать исходные соединения галогенов. А вот AgF в воде растворим, поэтому реактивом на F-, приходят к выводу ученики, может служить, например, ион кальция (например, СаСl2):
![]()
На втором уроке учитель использует рассказ с элементами беседы.
V. Краткие сведения о фторе, хлоре, броме и йоде («соло» учителя)
Фтор. Впервые познакомились с соединениями фтора на практике, очевидно, древние металлурги и алхимики, добивавшиеся понижения температуры плавления шлаков под действием фторида кальция. Название этого минерала — флюорит (от лат. «флюоре» — текущий) позднее отразилось и в названии самого элемента «флюор», которое сохранилось в большинстве мировых литературных источников. В русской химической литературе используется другое название— «фтор», что по-гречески означает «разрушающий» и более полно отражает сущность этого химического элемента.
Более 100 лет продолжался научный подвиг по получению фтора в виде простого вещества из его соединений, прежде всего из фтороводорода. Он стоил здоровья, а иногда и жизни многим выдающимся ученым. В шеренге, безуспешно штурмовавшей эту вершину, стоят Томас и Георг Ноксы, П. Лайет, Д. Никлес, Ж. Гей-Люссак, Г. Тенар, Г. Дэви, А. Лавуазье, Э. Ферми и даже М. Фарадей. Впрочем, слово «безуспешно» здесь не совсем уместно. Каждый опыт, пусть неудачный с точки зрения получения вещества, позволял что-то прояснить, отсечь одно из тупиковых направлений, провести совершенствование эксперимента. И когда А. Муассану в 1886 г. удалось получить фтор электролизом безводного фторида водорода, славу этого открытия и звание лауреата Нобелевской премии 1906 г. по праву должны были бы разделять его предшественники.
Фтор распространен в природе довольно широко, разумеется, в виде соединений (почему?). Промышленное значение имеют два из них: плавиковый шпат CaF2 и криолит Na3AlF6 или 3NaF· AlF3. Криолит (от греч. «криос» — холод и «литое» — камень) — «холодный или ледяной камень» встречается в Гренландии. Благодаря этому минералу удалось сделать промышленное производство алюминия доступным и дешевым (криолит понижает температуру плавления оксида алюминия, электролизом которого получают этот металл).
Фтор реагирует со многими простыми веществами (кроме Не, Аr, Ne, N2, С в виде алмаза). Так, это единственное простое вещество, которое непосредственно соединяется с благородными газами, долгое время считавшимися инертными: Кr, Хе, Rn.
Плавиковая кислота HF широко применяется в авиационной, химической, целлюлозно-бумажной промышленности; с ее помощью делают надписи и рисунки на стекле (отсюда и название — «плавиковая», т. е. «плавящая» стекло). Широко используются органические соединения фтора. Наиболее известны фреоны, например CF2Cl2 — дифтордихлорметан, который используется в холодильниках и кондиционерах в качестве «рабочего вещества».
Фтор входит в состав не только хладоагентов, но и полимеров, лекарств, моющих средств, ядохимикатов, красителей, компонентов искусственной крови. Среди них наиболее крупнотоннажный продукт — это фторопласт-4 (продукт полимеризации тетрафторэтилена C2F4), более известный как тефлон. Устойчивость этого полимера к агрессивным средам оценивается выше, чем у золота и платины. И это при наличии в его составе свыше 75% самого агрессивного из галогенов — фтора. (Учитель демонстрирует изделия с тефлоновым покрытием.)
Соединения фтора (это основа высокого качества зубных паст) предохраняют наши зубы от кариеса. В самих названиях этих паст часто указывается наличие препаратов фтора: «Фтородент», «Флюорайт» и т. д. (Учитель демонстрирует упаковки различных зубных паст и просит кого-либо из учащихся прочитать аннотацию по их составу.)
Однако, как и все в этом мире, так и фтор — это не только благо, но и большая экологическая проблема. Предлагаем вниманию учителей отрывок из статьи В. Н. Плахотника «Фториды вокруг нас» (Соросовский образовательный журнал. 1998. № 2).
Фтор и экология. Особого внимания заслуживает влияние фтора и его соединений на окружающую среду, в том числе и на человека. В поистине огромном диапазоне колеблется физиологическая активность фторидов. Чрезвычайно высокая устойчивость и полное отсутствие токсичности — с одной стороны, и хрестоматийные примеры мощнейших отравляющих веществ — с другой. Еще во время Второй мировой войны были созданы боевые отравляющие вещества нервнопаралитического действия, представляющие эфиры монофторангидрида фосфорной кислоты — зарин и зоман.

Сейчас фториды широко используются в медицине, растениеводстве и животноводстве. С ними связывают перспективу лечения рака и регулирование наследственности, создание мощных психотропных средств, транквилизаторов и новых антибиотиков.
Но эта ситуация не столько радужна, сколько тревожна. Физиологическое действие фторидов практически не изучено. По мнению профессора У. Кобаяси, организмы часто не отличают фтор от кислорода или водорода в органических соединениях и за счет этого «эффекта маскировки» он проникает в жизненно важные центры организма с опасной легкостью. Совершенно очевидно, что использованию сложных фторсодержащих препаратов должны предшествовать тщательные, многолетние и скрупулезные работы по особенностям их влияния на живые клетки, процессы обмена, жизнь нуклеиновых кислот. Вот только один из уроков, которые фторидные соединения уже преподали человечеству.
Увлечение фторсодержащими хладагентами и компонентами аэрозольных упаковок привело к значительному повышению концентрации этих соединений в атмосфере планеты. Напрямую они не влияют на растения, животных и человека, однако высокая инертность позволяет им сохраняться в атмосфере, подниматься в ее верхние слои и там в условиях разрежения и жестких излучений соприкасаться с озоном. Озон — аллотропная модификация кислорода — O3. Он образуется в верхних слоях атмосферы, составляя озоносферу. Молекулы озона поглощают жесткую солнечную радиацию — электромагнитное излучение с длиной волны менее 290 нМ. Организмы растений и животных очень чувствительны к жестким лучам, вызывающим болезни крови, гибель клеток и всего организма. Озоновый слой тысячелетиями служил надежным щитом жизни на Земле, охраняя ее поверхность от губительного излучения. Появление фреонов на больших высотах приводит к уничтожению и распаду озонового слоя. Вначале под действием жестких лучей от молекулы фреона отщепляется атом хлора Сl. Затем он взаимодействует с молекулой озона
![]()
Имеющиеся в озоносфере радикалы — атомы кислорода, образующиеся при диссоциации
![]()
взаимодействуют с СIO· по уравнению
![]()
в результате чего атомы хлора освобождаются и готовы к новому акту разрушения молекул озона. Специалисты считают, что один атом хлора в состоянии уничтожить около 100 тыс. молекул озона.
Озоновый слой начинает уменьшаться. В полярных областях его осталось всего 30%, а в конце 1995 г. над Антарктидой учеными впервые зафиксировано локальное полное исчезновение слоя озона— «озоновая дыра». Человечество с тревогой следит за развитием ситуации. Многие страны уже приняли решение о прекращении производства фреонов, спешно ищут альтернативные заменители (ведь невозможно же обходиться без холодильной техники). Кстати, одной из альтернатив может быть использование фторорганических соединений, не содержащих хлора, — перфорированных.
Даже сравнительно простые и более изученные неорганические фториды имеют свою специфику действия на человека. Уже в начале XX в. было известно, что недостаток фтора в организме при современных рационах питания вызывает появление кариеса. Это самая распространенная болезнь человечества. Многочисленные работы медиков во всем мире отчетливо показывают корреляцию между заболеваниями кариесом и парадонтозом и недостатком содержания фтора в питьевой воде, особенно у детей. Установлена даже ориентировочная граница минимума содержания фтора: 0,8—1,0 мг/л воды. Недостающий фтор восполняют фторированием воды, введением фторсодержащих препаратов в зубные пасты и эликсиры, выпуском таблеток с фторидами для детей.
В качестве занимательного момента для реализации межпредметных связей с литературой, и прежде всего так любимой подростками научно-фантастической, учитель может использовать на этом уроке произведения И. Ефремова «Сердце Змеи» и А. Днепрова «Глиняный бог».
Фабула первого в том, что отчаявшиеся найти разумную жизнь, подобную земной, космонавты готовили космический корабль к возвращению домой, как вдруг приборы сообщили, что прямо по курсу движется искусственный объект другой цивилизации. Когда космические корабли землян и инопланетян сблизились и на экранах появились изображения братьев по разуму, радости не было конца и у тех, и у других: инопланетяне оказались и внешне, и научным уровнем, и техническими достижениями очень похожи на землян. Корабли уже готовились к стыковке, как вдруг одному из командиров пришло в голову проверить, какое вещество используют другие для дыхания, в качестве окислителя пищи — источника энергии. Учитель ставит вопрос: «Как вы думаете, можно было информировать инопланетян о том, что таким веществом у нас на Земле является кислород?» Ученики предлагают много вариантов, которые резонно отметаются оппонентами, пока кто-либо из них не догадывается дать модель атома этого элемента («Кислород — он и на альфе-Центавра кислород»):
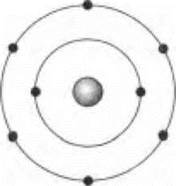
В ответ инопланетяне изобразили модель атома своего окислителя:
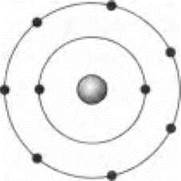
К ужасу землян, он оказался фтором — как выразился словами В. Высоцкого один из учеников: «Там хорошо, но нам туда не надо».
Учителю лишь остается спросить, а какое жидкое вещество должны использовать в качестве транспортного для внутренней среды своего организма фтородышащие люди, — ученики часто верно называют плавиковую кислоту.
Второй сюжет посвящен установлению аналогий между углеродом и кремнием, кислородом и фтором, водой и плавиковой кислотой. В «Глиняном боге» злой герой сумел освоить процесс замены углерода в веществах человеческого организма на кремний и создавать из людей каких-то кремнийсодержащих монстров, которым не страшны ни огонь, ни излучения. Управлял он этими монстрами с помощью плавиковой кислоты. Если кто-то не подчинялся ему, то тем самым он обрекал себя на своеобразные танталовы муки жажды: его лишали питья — плавиковой кислоты.
На основе этого сюжета учитель имеет возможность привлечь учащихся к прогнозированию и аргументации: «Чем отличались люди — монстры на кремниевой основе от обычных людей?», «Почему они должны были пить плавиковую кислоту?», «Почему автор романа из всей таблицы Менделеева выбрал кремний?», «Не лучше ли было в качестве химической основы использовать замену не углерода на кремний, а водорода на фтор?», «Будут ли Н и F аналогами подобно С и Si?» и т. д.
Хлор. История хлора как элемента и простого вещества ведет свое начало с 1774 г., когда шведский химик К. Шееле впервые получил его путем взаимодействия соляной кислоты с пиролюзитом:
![]()
А вот история соединений хлора стара как мир, и это, прежде всего, относится к поваренной соли. Алхимикам были известны соляная кислота и «царская водка» (смесь 3 объемов НСl и 1 объема HNO3).
Далее учитель может использовать схемы из учебника для рассмотрения областей применения хлора и соляной кислоты, которые сопровождает демонстрацией веществ, содержащих хлор, и изделий из них.
Будет неплохо, если он остановится на изотопах хлора: 35Сl и 37Сl.
Для закрепления знаний о степенях окисления учитель может назвать и кислородсодержащие соединения хлора, прежде всего кислоты:
хлорноватистую — НСlO,
хлористую — НСlO2,
хлорноватую — НСlO3,
хлорную — НСlO4,
и предложить учащимся записать формулы соответствующих им оксидов.
Бром. Медицина и фотография — основные области применения брома. (Демонстрация различных марок фотобумаги, кино- и фотопленки, медицинских препаратов, содержащих бром.)
Открывший бром в 1825 г. французский химик А. Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл».
Балар подействовал на раствор золы морских водорослей в воде хлором и заметил, что раствор стал красно-бурым. Понятно, что в этот цвет окрасил его выделившийся бром. А ведь аналогичную реакцию наблюдал раньше француза знаменитый немецкий химик Юстус Либих, который не стал ее исследовать, так как решил, что она содержит смесь хлора с йодом. Он «проглядел» открытие нового химического элемента и горько сожалел об этом: «Не может быть большего несчастья для химика, как то, когда он сам не способен освободиться от предвзятых идей, а старается дать всем явлениям, не сходящимся с этими представлениями, объяснения, не основанные на опыте».
Соединения брома используют не только в медицине и фотографии. Бромид натрия NaBr добавляют в дубильные растворы для получения более твердой кожи.
Из прозрачных кристаллов КВr делают линзы, которые великолепно пропускают инфракрасные лучи и применяются в приборах ночного видения.
Бромид лития LiBr предотвращает коррозию в холодильных установках, обезвоживает минеральные масла, помогает кондиционировать воздух.
В текстильной промышленности широко используют броминдиго, с помощью которого получают целую гамму ярких и чистых цветов — от синего до красного.
Йод. Йод, как и бром, получают из золы морских водорослей, в первую очередь из ламинарий, которую иногда называют морской капустой. Получают и из природных йодсодержащих растворов — попутных нефтяных вод, соленых вод некоторых озер.
Впервые получил йод французский химик Б. Куртуа (1811) «в виде черного порошка, превращающегося при нагревании в пары великолепного фиолетового цвета». (Учитель может продемонстрировать возгонку нескольких кристалликов йода в большой закрытой колбе.)
Недостаток йода вызывает нарушение в обмене веществ. Поэтому в РФ пищевую соль йодируют — добавляют в нее иодиды. (Демонстрация упаковок с йодированной солью.)
Спиртовая настойка йода (учитель помещает несколько кристалликов Йода в пробирку и приливает к ним 1—2 мл спирта, встряхивает ее — получается йодная настойка) — обязательная принадлежность любой домашней, автомобильной или лабораторной аптечки. Но при использовании такой настойки следует помнить, что им обрабатывают не открытую рану, а ее края, так как в больших дозах йод вызывает ожоги и отравления.
Йод входит в состав одного из важнейших гормонов — тироксина (содержание йода в нем достигает 65%), который вырабатывается щитовидной железой. Недостаток его ведет к зобной болезни; именно для профилактики ее используют йодированную соль. Небольшие дозы раствора йода использовались жителями районов, пострадавших от аварии на Чернобыльской АЭС для выведения из организма радионуклидов. При добавлении в пищу домашних животных йодсодержащих водорослей у коров увеличивается удой молока, а у овец быстрее растет шерсть, повышается яйценоскость кур и лучше идет откорм свиней. Главными потребителями йода являются фармацевтическая, химическая, фото- и кинопромышленность.
Астат. Этот элемент был предсказан Д. И. Менделеевым под названием экайода и стал вторым после технеция синтезированным элементом. Его синтез провели американские ученые Д. Корсон, К. Маккензи и Э. Сегре (1940 г.) по ядерной реакции:
![]()
В настоящее время известно 20 искусственных радиоактивных изотопов астата. Все они короткоживущие (отсюда и название элемента: по-гречески «астатос» означает «неустойчивый»). Астат похож на йод, но имеет более ярко выраженный металлический характер.
Информацию об астате, как и многое из приведенного выше материала, не обязательно использовать на уроках. Это просто невозможно (нельзя объять необъятное). Однако некоторые фрагменты этой информации учитель может включить в содержание урока в зависимости от того, на какие достигаемые цели он делает акцент (усиление гуманизационного потенциала, развивающий или экологический аспекты, реализация идей межпредметного содержания и т. д.).
Так, материал об астате — это ответ на нередко задаваемые учениками вопросы о том, что представляет собой этот галоген.