Настольная книга учителя по химии 9 класс - поурочные разработки
Серная кислота и ее соли - Неметаллы
Цели урока. Конкретизировать общие знания учащихся о свойствах кислот в свете ТЭД на примере разбавленной серной кислоты и знания об ОВР на примере концентрированной серной кислоты. Показать народнохозяйственное значение этой кислоты и ее солей.
Оборудование и реактивы. H2SO4 (разб. и конц.), Zn, Сu, СuО, растворы CuSO4, NaOH, Na2CO3, ВаСl2, таблетки норсульфазола, сахарная пудра. Пробирки, эксикатор, фильтровальная бумага, горелка, сухое горючее, спички.
I. Получение серной кислоты
Учитель просит учащихся спрогнозировать схему получения S03, опираясь на сведения о нахождении серы в природе и об ее оксидах.
Три стадии производства серной кислоты можно дать в контексте учебника:

Если класс сильный или на химию выделено 3 ч в неделю, то учитель может остановиться на двух промышленных способах получения серной кислоты. Они отличаются в основном катализом проведения 2-й стадии — окисления SO2 в SO3.
1-й способ. С помощью твердого катализатора— оксида ванадия (V) V2О5. Механизм этого катализа преимущественно адсорбционный: поверхность катализатора поглощает газообразныеSО2 и О2, увеличивая тем самым их концентрацию, а следовательно, по закону действия масс и скорость химической реакции. Это контактный способ производства H2SО4.
2-й способ. С помощью газообразного оксида азота (II). Механизм этого катализа состоит в образовании промежуточного вещества — оксида азота (IV):
а) вначале NО взаимодействует с О2 и образуется промежуточный продукт: NО + 1/2O2 = NO2
б) затем NО2 взаимодействует с SО2 и образуется SО3 и катализатор:
![]()
Это нитрозный способ производства серной кислоты. Учителю также необходимо подчеркнуть особенности протекания 3-й стадии: оксид серы (VI) растворяют не в воде (так как при этом выделяется большое количество теплоты и образовавшиеся пары затрудняют дальнейшее растворение), а в концентрированной серной кислоте. Получившийся раствор оксида серы (VI) в серной кислоте называется олеумом, из которого в дальнейшем по итоговой реакции и получают серную кислоту:
![]()
Затем учитель знакомит ребят с аппаратами контактного способа производства серной кислоты.
II. Применение серной кислоты
Нет ни одной отрасли химической промышленности, где бы ни находила применение серная кислота. Одна из главнейших областей ее использования — производство искусственных минеральных удобрений: фосфорнокислого удобрения (суперфосфата) и азотного удобрения (сернокислого аммония). Серная кислота необходима также для производства других кислот. Поэтому ее называют хлебом химической промышленности.
Серная кислота используется и при изготовлении почти всех взрывчатых веществ. Кроме того, она необходима для получения сернокислых солей, для очистки бензина, керосина и смазочных масел, зарядки свинцовых аккумуляторов и т. д. Серная кислота в виде так называемых травильных растворов применяется в металлообрабатывающей промышленности, где она служит для снятия окалины и загрязнения с металлических изделий перед их окраской или покрытием другими металлами (никелем, хромом и т. д.).
III. Свойства разбавленной серной кислоты
Это типичные свойства кислот. Учитель просит ребят дома самостоятельно записать уравнения реакций H2SO4 (разб.) в молекулярном и ионном виде (для сильных ребят лучше наоборот):
• с металлами до (Н), например с Zn;
• с оксидами металлов, например с СuО;
• с основаниями, например с Сu(ОН)2 и NaOH;
• с солями, например с Na2CO3 и ВаСl2.
Учащиеся или проделывают так хорошо им знакомую лабораторную работу, или, с целью экономии времени, наблюдают за демонстрацией опытов, проводимых учителем.
IV. Свойства концентрированной серной кислоты
Учитель демонстрирует следующие опыты:
1) разбавление концентрированной серной кислоты (необходимо повторить соответствующее правило);
2) гигроскопические свойства H2SO4 (конц.):
• обугливание лучинки, бумаги, сахарной пудры;
• применение в эксикаторе для осушивания веществ (рис. 24).
Рис. 24. Эксикатор
Можно сделать надпись разбавленной серной кислотой до урока на кружке плотной фильтровальной бумаги, например знак S. Затем на уроке показать ребятам «чистый» белый кружок (он успевает подсохнуть), а затем «проявить» надпись, подержав кружок бумаги над пламенем горелки;
3) взаимодействие концентрированной серной кислоты с металлами, объясняет учитель, совершенно отличается от реакции с ними для разбавленной кислоты. Очевидно, в силу того что она содержит очень мало воды (например, лабораторная кислота всего 5%), окислителями будут не катионы Н+ (их в такой кислоте нет), а молекулы серной кислоты (точнее, ![]() входящая в ее состав). Поэтому H2SO4 (конц.) окисляет многие металлы, независимо от их положения в ряду напряжений, при этом образуя не Н2, а восстанавливаясь до S, SO2 или H2S в зависимости от металла и условий реакции.
входящая в ее состав). Поэтому H2SO4 (конц.) окисляет многие металлы, независимо от их положения в ряду напряжений, при этом образуя не Н2, а восстанавливаясь до S, SO2 или H2S в зависимости от металла и условий реакции.
Демонстрируется взаимодействие H2SO4 (конц.) с медью при нагревании и разбирается ОВР:

Учитель может подчеркнуть, что H2SO4 (конц.) не реагирует со многими металлами при обычных условиях. Поэтому ее можно хранить в железной таре, перевозить в стальных цистернах. Кстати, в стальных цистернах по железной дороге перевозят также меланж — смесь концентрированных серной и азотной кислот.
V. Соли серной кислоты
Как двухосновная кислота, H2SO4 в растворе диссоциирует ступенчато:
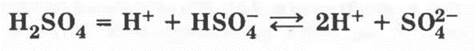
Для сильных учеников можно поставить проблемный вопрос: почему для записи каждой степени диссоциации используются разные знаки?
Серная кислота образует два ряда солей:
1) кислые, или гидросульфаты, например NaHSO4;
2) средние, или сульфаты, например Na2SO4.
Все гидросульфаты и большинство сульфатов хорошо растворимы в воде. Малорастворимы CaSO4 и Ag2SO4, еще менее — PbSO4 и практически нерастворим BaSO4. Поэтому реактивом на сульфат-ион является ион бария:
![]()
Если позволит время (3 ч в неделю или будущая 12-летняя школа), то можно рассказать о представителях солей, вспомнить кристаллогидраты, показать образцы природных материалов, гипсование и т. д. Поэтому дадим короткую информацию о солях серной кислоты.
VI. Применение солей серной кислоты
К солям серной кислоты, имеющим широкое применение, относятся медный и железный купорос, глауберова соль и гипс.
Медный купорос CuSO4 · 5Н2O применяется для изготовления зеленых и синих красок, для борьбы с вредителями растений и в электротехнике.
Железный купорос FeSO4 · 7Н2O служит для получения других солей железа. Он образуется при растворении железа в серной кислоте.
Безводный сернокислый натрий Na2SO4, так называемый сульфат, является одним из важнейших материалов для стекловарения.
Кристаллический сернокислый натрий Na2SO4 · 10Н2O, называемый «глауберова соль», применяется в медицине.
Природный гипс служит для улучшения свойств почвы. Гипс CaSO4 · 2Н2O широко распространен в природе. Богатейшие месторождения его находятся в Поволжье, на Урале и в других местах. При нагревании не выше 150 °С гипс теряет часть своей кристаллизационной воды и переходит в жженый гипс, или алебастр, или полуводный гипс 2CaSO4 · Н2O. Некоторые сорта природного гипса также называют алебастром. Если из алебастра приготовить тестообразную массу, смешав его с водой, то через некоторое время эта масса застынет, так как жженый гипс присоединяет воду и снова превращается в CaSO4 · 2Н2O. При этом массе можно придать любую форму, благодаря чему алебастр нашел себе широкое применение в строительном деле, для формовки всевозможных изделий, изготовления гипсовых скульптур и т. п.
VII. Занимательный опыт
В заключение расскажем еще об одном интересном опыте, который может служить моделью опыта взаимодействия серной кислоты с сахарной пудрой. На большую таблетку сухого горючего положить две таблетки норсульфазола и поджечь горючее — из таблеток норсульфазола поползут «черные змеи». Суть и в том, и в другом случае состоит в образовании С02 и S02, которые и «пучат» реагирующие вещества.