Настольная книга учителя по химии 9 класс - поурочные разработки
Азот - Неметаллы
Цели урока. Конкретизировать знания учащихся о строении атома и ковалентной неполярной связи на примере строения атома и молекулы азота. Рассмотреть физические и химические свойства азота в свете ОВР. Показать значение азота как биогенного элемента, познакомить учащихся с нахождением его в природе.
Оборудование и реактивы. Кристаллические (NH4)2Cr2O7, S, NaNO2, NH4Cl; спирт, ступка с пестиком, фарфоровая чашечка, пробирки, прибор для получения газов, горелка, спички.
I. Строение атома
Учащиеся самостоятельно в ходе беседы дают характеристику 1-й формы существования этого элемента — его атома.
![]()
На основе анализа положения азота в Периодической системе и значения ЭО они прогнозируют его свойства.
I. Окислительные свойства

Учащиеся предлагают формулы таких соединений — нитридов: Li3N, Ca3N2, AlN и H3N (в силу исторических традиций формулу нитрида азота — аммиака — продолжают не совсем точно записывать NH3).
II. Восстановительные свойства
 (информацию о положительных с. о. дает учитель)
(информацию о положительных с. о. дает учитель)
Учащиеся предлагают формулы соответствующих оксидов и фторидов (для последнего — NF3).
II. Строение молекулы
Этот материал также не вызывает у учащихся затруднений.
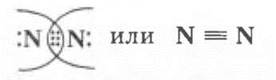
Они характеризуют химическую связь в молекуле:
• ковалентная неполярная;
• образована по обменному механизму за счет спаривания непарных электронов;
• тройная.
Именно последняя характеристика связи и объясняет чрезвычайную прочность и почти инертные свойства молекулярного азота.
III. Свойства азота
Газ без цвета, запаха и вкуса. При охлаждении до -196 °С превращается в бесцветную жидкость, а при -210 °С— в белую снегообразную массу. В воде малорастворим, хуже кислорода, поэтому вода, соприкасаясь с воздухом, растворяет больше кислорода.
I. Окислительные свойства
1. Взаимодействует с металлами при нагревании и только с литием при комнатной температуре, образуя нитриды:
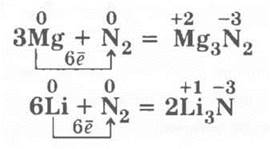
2. Взаимодействует с водородом в присутствии катализатора, при высоком давлении и температуре:
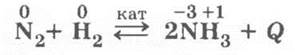
Здесь уместно повторить все классификационные признаки реакций синтеза аммиака и условия смещения равновесия вправо (по аналогии с обратимой реакцией получения SO3).
II. Восстановительные свойства азота рассматриваются на примере синтеза оксида азота (II) при температуре электрической дуги (3000—4000 °С) и учащимися самостоятельно дается полная характеристика этой реакции и разбираются условия смещения равновесия вправо:

IV. Азот в природе
Учащиеся сами называют источник свободного азота. Они вспоминают состав воздуха: 78% по объему и 75,6% по массе приходится на долю N2. Из наиболее известных минеральных веществ учитель называет натриевую, или чилийскую, селитру.
Азот входит в состав белков, которые являются важнейшими носителями жизни. В среднем белок на 16% состоит из азота.
V. Занимательные опыты
Этот урок беден химическим экспериментом, поэтому можно показать получение азота в качестве одного из продуктов красивейшей реакции разложения бихромата аммония — хорошо известный всем «вулкан»:
![]()
Техника выполнения этого опыта проста: чайную ложечку оранжевых кристаллов бихромата аммония хорошо растирают в ступке. Растертую соль помещают горкой на керамической плитке, кусочке картона или просто в фарфоровой чашечке, сверху делают углубление — «кратер», капают 2—3 капли спирта (можно обойтись и без него) и поджигают.
Вторая реакция — это необычная реакция замещения серой азота.
В ступке растирают смесь 1 г серы и 4,3 г нитрита натрия NaNО2. Растертую смесь помещают на металлическую пластину или в тигель и осторожно поджигают спичкой — протекает эффектная пиротехническая реакция:
![]()
Получать азот в лаборатории можно из смеси концентрированных водных растворов нитритов натрия и хлорида аммония при нагревании:
![]()