Настольная книга учителя по химии 9 класс - поурочные разработки
Соли азотной кислоты - Неметаллы
Цели урока. Дать понятие о нитратах. Рассмотреть их физические и химические свойства. Познакомить учащихся с важнейшими представителями и показать их значение в народном хозяйстве и быту. Дать представление об азотных удобрениях, их классификации и представителях.
Оборудование и реактивы. Сu, H2SO4; кристаллические NaNO3, KNO3, Ca(NO3)2, NH4NO3; AgNO3 (ляписный карандаш); древесный уголь, S, KNO3 (конц.). Штатив, прибор для получения газов, горелка, спички, тигельные щипцы, писчая бумага, пипетка. Коллекция азотных удобрений.
I. Нитраты и их свойства
Учитель спрашивает о том, возможно ли образование кислых солей азотной кислоты. Учащиеся верно отвечают, что нет, ибо HNO3 — одноосновная кислота и потому образует только один ряд солей — средние или нитраты.
Нитраты натрия, калия, аммония и кальция называются селитрами. На основе анализа состава и строения нитратов, а также таблицы растворимости учащиеся говорят о том, что все нитраты — кристаллические вещества с ионной кристаллической решеткой, все — хорошо растворимы в воде.
Соли азотной кислоты
Учитель подчеркивает, что общими свойствами для всех нитратов будет их хорошая диссоциация в водных растворах и реакции ионного обмена, в основном для катионов. А вот нитрат-анионы распознают опосредованно: если к соли или ее раствору добавить медь и серную кислоту и смесь подогреть, то выделяется бурый NO2 (учитель проводит демонстрацию взаимодействия смеси NaNO3, Сu и H2SO4 при нагревании в пробирке).
Твердые нитраты можно распознать также по вспышке на раскаленном угольке щепоточки кристалликов соли (демонстрация!).
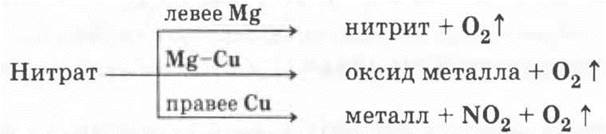
Этот эффект является следствием общего свойства нитратов разлагаться при нагревании с выделением кислорода. Характер других продуктов, образующихся при этом, зависит от положения металла, образующего нитрат, в ряду напряжений:
Учитель проделывает эффектные демонстрации.
1. Разложение калийной селитры. В пробирку насыпается немного селитры, и она укрепляется в лапке штатива. Пробирка подогревается с помощью горелки — селитра легко плавится и в нее с помощью щипцов бросается раскаленный в пламени горелки уголек. Он раскаляется, подпрыгивает в пробирке, быстро уменьшается из-за сгорания, выделяя хлопья сажи.
Аналогично взаимодействует с расплавленной селитрой и щепотка серы, высыпанная в другую пробирку:
![]()
и далее: ![]()
2. Другая модификация этого опыта состоит в проявлении невидимой надписи «огнем — художником». Надпись делают так. В 20 мл воды растворяют 1/2 чайной ложки калийной селитры. На листе бумаги делается рисунок или надпись с помощью пера, или спички, или пипетки, смоченных приготовленным концентрированным раствором селитры. Окончание линии отмечается карандашной точкой. Когда рисунок или надпись высохнут, его поджигают тлеющей лучинкой или спичкой в месте, отмеченном точкой.
3. Разложение ляписа — демонстрируется действие ляписного карандаша на бородавки; они чернеют из-за образовавшегося серебра:
![]()
4. Горение черного пороха. В фарфоровую чашечку помещают тщательно смешанную смесь трех веществ — калийной селитры, угля и серы (в массовом отношении 7,5:1,5:1), которую поджигают длинной горящей лучинкой. Происходит яркая вспышка — взрыв.
II. Применение нитратов
1. Все селитры: NaNO3, KNO3, Ca(NO3)2 — используют главным образом как минеральные азотные удобрения.
2. Нитрат калия KNO3 также для изготовления черного пороха.
3. Нитрат аммония NH4NO3 в смеси с порошками алюминия и угля — для изготовления взрывчатки (аммонала).
4. Нитрат серебра AgNO3 — для медицинских целей, в том числе как ляписный карандаш (для прижигания бородавок).
III. Азотные удобрения
Учитель начинает рассматривать этот материал, поставив перед ребятами проблему: ведь азота в природе, в составе атмосферы чрезвычайно много, а растения часто дают плохой урожай из-за азотного голодания. Почему?
Оказывается, только клубеньковые бактерии, которые поселяются на корнях бобовых растений, способны связывать азот, т. е. превращать его из простого вещества в ионы сложных веществ. Эти бактерии являются как бы маленькими биолого-химическими фабриками по производству азотных удобрений, которыми они делятся с бобовыми, а те взамен обеспечивают такие бактерии синтезированными в процессе фотосинтеза органическими веществами. Ребята с радостью узнают знакомое им из курса биологии явление — симбиоз (рис. 34). Подавляющее большинство же растительных организмов не способно усваивать атмосферный азот. Они могут поглощать из почвы азот только в связанном виде, т. е. в виде ионов. Часть такого азота возвращается в почву в виде остатков растений и животных, в виде птичьего помета, навоза или компоста. Последние три, если они вносятся на поля человеком, — это органические удобрения.
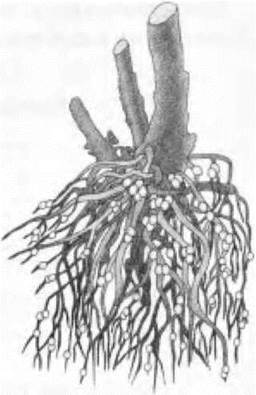
Рис. 34. Клубеньки на корнях бобовых растений
Часть связанного азота поступает в почву во время гроз в виде образовавшейся при этом азотной кислоты. Учитель просит написать уравнения происходящих при этом реакций и далее разбирает круговорот азота в природе (рис. 35).
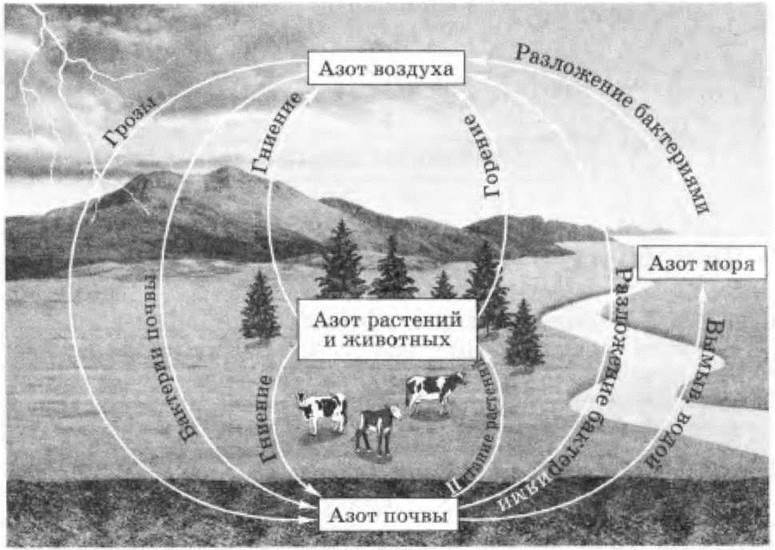
Рис. 35. Круговорот азота в природе
Однако в процесс круговорота азота в природе вмешивается человек. Снимая урожаи, человек ежегодно уносит вместе с ними огромные количества связанного азота. Эту убыль он покрывает внесением не только органических, но и минеральных удобрений (нитратных, аммиачных, аммонийных).
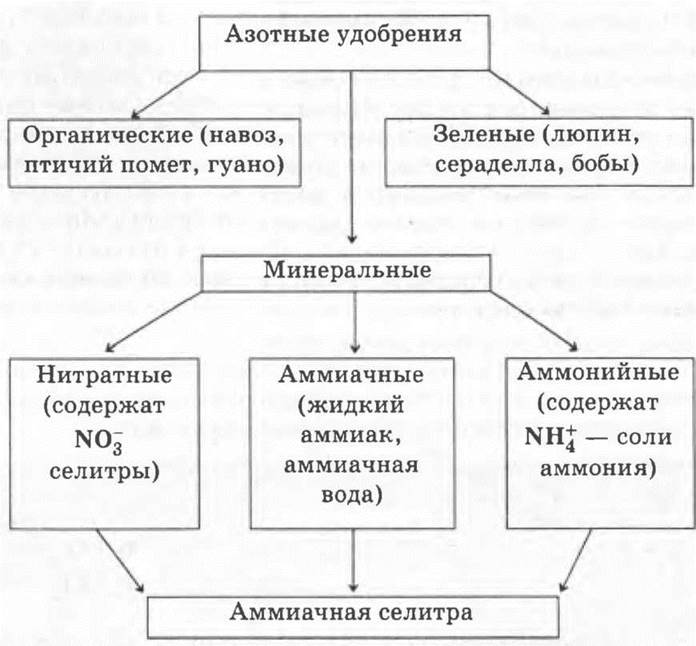
В заключение учитель предлагает опорную схему-конспект (схема 3) по классификации азотных удобрений.
Схема 3. Классификация азотных удобрений