Настольная книга учителя по химии 9 класс - поурочные разработки
Фосфор и его соединения - Неметаллы
Цели урока. Повторить строение атома, аллотропию и сравнительную характеристику красного и белого фосфора. Рассмотреть кислородные соединения фосфора: оксид фосфора (V), фосфорную кислоту и ее соли. Дать представление о фосфорных удобрениях.
Оборудование и реактивы. Р (кр.), лакмус, Н2O, растворы NaOH, фенолфталеина, Na2CO3, AgNO3, HNO3, если возможно, КСlO3. Коллекция фосфорных удобрений, CS2, свеча. Ложечка для сжигания веществ, колба, пробирки, спички.
I. Фосфор
Весь материал по фосфору разбирается в плане повторения уже известных учащимся сведений.
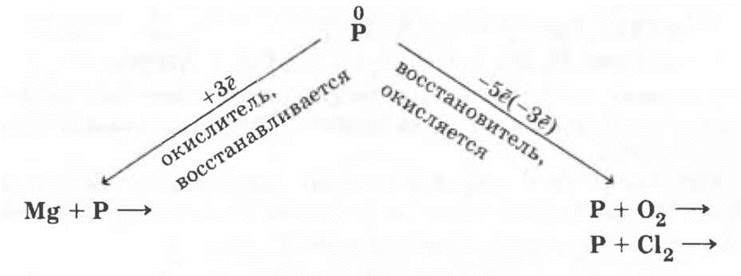
1. Строение атома они сравнивают со строением атома азота, делают вывод о том, что оба элемента имеют одинаковые значения низших степеней окисления -3, если проявляют окислительные свойства (например, с металлами), и +5, если проявляют восстановительные свойства (по отношению к более электроотрицательным элементам). Восстановительные свойства у фосфора выражены сильнее из-за большего значения радиуса его атома.
2. Простые вещества. В отличие от азота для фосфора характерно явление аллотропии. Сравниваются строение, свойства, получение и применение модификаций фосфора. Учителю остается лишь обобщить в виде опорного конспекта химические свойства фосфора:
(соответствующие уравнения учащиеся записывают самостоятельно) и отметить, что в отличие от аммиака фосфин — РН3 — получают не синтезом, а преимущественно косвенно, через фосфиды:
![]()
Подобно водородным соединениям элементов других подгрупп, РН3 по сравнению с NH3 менее прочен и более реакционноспособен.
II. Оксид фосфора (V) и фосфорная кислота
Эта часть урока также проводится в форме повторительного обобщения уже имеющихся у учащихся сведений о кислотных оксидах и кислотах.
Учитель повторяет демонстрацию горения фосфора в ложечке, которую вносит в колбу, заполняет ее густым белым дымом твердых частичек Р2O5, приливает в нее воды и, закрыв пробкой, взбалтывает до полного растворения Р2O5 в воде. Полученный раствор испытывается лакмусом, чем и доказывается образование фосфорной кислоты. Опять предлагается схема опорного конспекта.
Р2O5 — кислотный оксид. Он взаимодействует:
1) с водой: ![]()
2) с основными оксидами: ![]()
3) со щелочами: ![]()
Н3РO4 — кислота (трехосновная, кислородная, нелетучая, средней силы — устно!). Она взаимодействует:
1) с металлами не взаимодействует (почему?)
2) с основными оксидами: ![]()
3) со щелочами: ![]()
4) с солями: ![]()
(аналогично уравнения в молекулярном и ионном виде — здесь в этом порядке, а не наоборот, почему? — учащиеся запишут дома).
При двух часах химии в неделю лабораторная работа по свойствам фосфорной кислоты не проводится, а лишь демонстрируется качественная реакция на РО43-:

Этот осадок, в отличие от AgBr и Agl, растворяется при приливании к нему раствора кислоты.
III. Соли фосфорной кислоты
Учитель напоминает, что кислые соли не образуют одноосновные кислоты, а только многоосновные, и спрашивает учащихся, сколько рядов солей дает фосфорная кислота.
Результаты этой небольшой беседы и следующее за ней объяснение оформляются еще в один опорный конспект (табл. 4).
Таблица 4. Соли H3PO4
|
Соли |
Ион кислотного остатка |
Примеры |
Растворимость |
|
I. Дигидрофосфаты II. Гидрофосфаты Кислые соли |
Н2РО4- НРО42- PO43- |
Са(Н2РО4)2 СаНРО4 Са3(РО4)2 |
Все растворимы Мало растворимы, кроме солей К+, Na+ и NH4+ |
|
III. Фосфаты — средние соли |
Все нерастворимы, кроме солей К+ и Na+ |
IV. Фосфорные удобрения
Учитель подчеркивает, что минеральное питание растений происходит с помощью элементов, содержащихся в почвенном растворе в виде ионов, поэтому в качестве фосфорных удобрений могут с успехом применяться растворимые соли Н3РО4 — дигидрофосфаты, например Са(Н2РО4)2, входящий в состав различных суперфосфатов.
Гидрофосфаты и фосфаты (кроме растворимых солей щелочных металлов) в силу малой растворимости и нерастворимости соответственно применяются на кислых почвах, где под действием содержащихся в таких почвах катионов Н+ превращаются в растворимые дигидрофосфаты и усваиваются растениями. Это, например, фосфоритная мука — Са3(РО4)2 и преципитат — СаНРО4.
Наиболее ценными являются аммофосы, которые хорошо растворимы и содержат два питательных элемента — азот и фосфор: NH4H2PО4 и (NH4)2HPО4.
V. Дополнительный материал к уроку
Этот материал можно включить небольшими фрагментами в урок для повышения интереса учащихся к его содержанию.
К уже известному из курса химии 8 класса открытию фосфора Г. Брандтом в 1669 г. можно сообщить интересные сведения о развернувшейся «фосфорной лихорадке». Брандт продает свой секрет дрезденскому алхимику Крафту, который оказался более предприимчивым. Изготовив достаточное количество фосфора, Крафт отправился в длительный вояж по Европе, где с большим успехом демонстрировал его свойства перед знатными особами, извлекая большую выгоду.
Время шло. Постепенно расширялся круг людей, знающих секреты получения фосфора. Светоносный элемент по-прежнему слыл таинственным. Этому способствовало и суеверное отношение к неизвестному прежде явлению, и неумирающая надежда на то, что секрет получения золота близок к разгадке.
К истории фосфорсодержащих соединений приложил свою руку и знаменитый английский химик Роберт Бойль.
Выведав у Крафта, когда тот демонстрировал светящееся вещество английскому королю Карлу II, как получать фосфор, Бойль начал изучать его свойства. И уже скоро пришел к открытию фосфорной кислоты и фосфористого водорода, опубликовав данные о свойствах элемента. Методику получения фосфора ученый обнародовать почему-то не стал, а сообщил о ней в закрытом пакете Лондонскому королевскому обществу. Это сообщение увидело свет лишь после смерти ученого.
Фосфор не принес богатства ни Брандту, ни Бойлю. Он обогатил таких дельцов, как Крафт и ассистент Бойля Хенквиц, который в течение пятидесяти лет торговал фосфором по высокой цене. В 1743 г. один из ведущих металлургов и химиков того времени Андрей Маркграф открыл более совершенный способ получения фосфора и опубликовал его в «Записках Берлинской академии». С этого времени начинается систематическое изучение светоносного элемента и его соединений.
Учитель может показать самовозгорание свечи. Для этого ее распушенный фитиль смачивают раствором фосфора в сероуглероде, и, когда тот испарится, свеча загорается.
Аналогично на химических вечерах на стене можно сделать подобным раствором слова. По мере испарения сероуглерода надпись начинает все сильнее светиться, а потом вспыхивает и пропадает.
Учитель может сообщить и об интересных суевериях, связанных с соединениями фосфора. Так, он рассказывает: «Вспомним, сколько всевозможных суеверий, мрачных легенд порождали «блуждающие» огни на кладбищах и болотах. Фантазия народная испокон веков заселяла кладбища душами грешников, выходящими по ночам из могил, а болота — чертями. Между тем «блуждающие» огни обязаны своим происхождением естественным биохимическим и химическим процессам. Растительные и животные остатки содержат фосфор. Попадая в почву, они под влиянием влаги, тепла, микроорганизмов разлагаются. В результате выделяются газ метан, способный гореть, и фосфин, который активно реагирует с кислородом воздуха. Реакция сопровождается большим выделением тепла, под влиянием которого фосфористый водород воспламеняется сам и поджигает метан. То, что кажется таинственным, даже страшным, — естественное, легко объяснимое явление».
И, наконец, информация о спичках.
В прежнее время для производства спичек применялся белый фосфор, который в смеси с серой и некоторыми богатыми кислородом веществами входил в состав головки спички; сверху головку покрывали слоем парафина (во избежание окисления на воздухе). Вследствие огнеопасности таких спичек (они загораются уже при легком трении) и вреда для здоровья рабочих производство их было повсюду запрещено и заменено изготовлением так называемых безопасных или «шведских» спичек, в которых белый фосфор заменен красным (вспомните замечательное произведение А. П. Чехова, которое так и называется «Шведская спичка»). Красный фосфор вместе с сульфидом сурьмы (III) Sb2S3 и клеем наносится на боковые поверхности коробки, а головка спички составляется обычно из бертолетовой соли, серы, стеклянного порошка и клея.
Под действием теплоты, выделяющейся при трении, мельчайшие частицы красного фосфора переходят в белый фосфор, который воспламеняется на воздухе и поджигает головку спички.
Интересно отметить, что спички появились только 120 лет назад, а до начала XIX в. огонь добывался исключительно при помощи кремня и огнива.