Настольная книга учителя по химии 9 класс - поурочные разработки
Характеристика переходного элемента на основании его положения в Периодической системе. Амфотерность - Введение
Цели урока. Продолжить формирование умения давать характеристику элемента на примере переходного элемента. Дать понятие об амфотерности. Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ.
Оборудование и реактивы. Растворы едкого натра, соляной кислоты, солей цинка и алюминия (вместо последней — лучше алюмокалиевые квасцы); пробирки.
I. Понятие об амфотерности и переходных металлах
Проблемная ситуация на этом этапе урока формируется в ходе химического эксперимента: или лабораторной работы, или демонстрационного эксперимента (в этом случае будет неплохо использовать штатив для демонстрационных пробирок с подсветкой) по получению амфотерного гидроксида алюминия или цинка и доказательства его амфотерности.
Учитель просит учащихся определить растворимость гидроксида алюминия или цинка с помощью таблицы растворимости и предложить пути его получения. Ребята без труда называют способ получения: реакция обмена между щелочью и растворимой солью переходного металла.
Проводится опыт «Получение амфотерного гидроксида алюминия и изучение его свойств».
Несколько практических советов по его проведению. Во всех методических пособиях (равно как и в учебниках) предлагается свежеприготовленный осадок амфотерного гидроксида делить на две равные части в две пробирки. Такая технология очень неэстетична: на стенках пробирок остаются потеки осадка-геля, а если опыт проводится с малым количеством реактивов, то и вовсе весь осадок размазывается по стенкам пробирок. Будет лучше, если амфотерный гидроксид сразу получают в двух пробирках: в обе приливается по 2 мл раствора соли, а затем с помощью пипетки — несколько капель щелочи, образуется белый осадок. Для доказательства амфотерности в одну пробирку приливается раствор кислоты, а в другую — раствор щелочи. Осадки растворяются.
Еще один совет. Для того чтобы хорошо растворился осадок с избытком щелочи (очень часто раствор остается немного мутноватым), последнюю нужно брать поконцентрированнее, а иногда и подогревать реагирующую смесь.
Очень эффектно, без проблем растворяется в избытке щелочи осадок гидроксида алюминия, который был получен не из хлорида или сульфата, а из алюмокалиевых квасцов, — в этом случае получается раствор такой же прозрачности, как и в случае реакции гидроксида алюминия с кислотой.
По итогам эксперимента учитель подводит учащихся к выводу, что гидроксиды некоторых химических элементов будут проявлять двойственные свойства — и основные, и кислотные — в зависимости от сореагента. Такие гидроксиды называют амфотерными, а элементы — переходными. В нашем учебнике в ПСХЭ символы таких элементов обозначены зеленым цветом, символы элементов, у которых гидроксиды являются основаниями, — черным, а элементы, которым соответствуют кислотные гидроксиды, — красным (искл. инертные газы). Аналогичный характер имеют и оксиды, соответствующие основным, кислотным и амфотерным гидроксидам.
Много споров у учителей и методистов вызывает и форма отражения проделанных реакций на письме: как записывать уравнения реакций амфотерных гидроксида и оксида алюминия со щелочью? По химии цинка — полное согласие — консенсус: Zn(OH)2 = H2ZnO2 и, соответственно, записывается соль состава Na2ZnO2.
Записывать формулы комплексов мешает отсутствие знаний о них и сложность формул, а формулу метаалюмината NaAlO2 сознание того, что соль с такой формулой образуется только при сплавлении твердых щелочи и оксида или гидроксида алюминия. Как быть? Мы предлагаем, не мудрствуя лукаво, записывать просто и понятно (особенно для слабых детей): Аl(ОН)3 = Н3АlO3и, соответственно, формулу ортоалюмината Na3AlO3.
Соответствующие ионные уравнения:
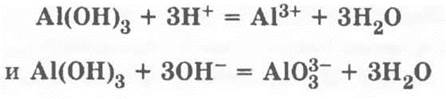
II. Характеристика алюминия по его положению в Периодической системе
1. Алюминий — это элемент 3 периода, главной подгруппы III группы или IIIA группы.
2. Строение атома алюминия можно отразить с помощью такой записи:
![]()
Отсюда следует, что атомы алюминия, так же как и алюминий — простое вещество, проявляют сильные восстановительные свойства (ученики сами называют окислители — неметаллы, Н+, ионы менее активных металлов), получая в результате с. о. +3. Восстановительную способность и металлические свойства в сравнении с соседями по периоду и группе можно отразить с помощью записей:
|
Mg > Аl > Si и Be < Аl < Ga |
|
|
металлические и восстановительные свойства уменьшаются |
металлические и окислительные свойства усиливаются |
3. Алюминий — простое вещество, это металл. Следовательно, для него характерны металлическая кристаллическая решетка (и соответствующие физические свойства) и металлическая химическая связь, схему образования которой можно записать так:
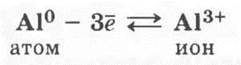
4. Оксид алюминия Аl2O3 — это солеобразующий амфотерный оксид. Соответственно, взаимодействует с кислотами и кислотными оксидами, со щелочами и основными оксидами, но не с водой.
Уравнения реакций для взаимодействия Аl2O3 с кислотами и щелочами записываются в ионной и молекулярной формах.
5. Гидроксид алюминия Аl(ОН)3 = Н3АlO3 — это нерастворимый амфотерный гидроксид. Соответственно, он разлагается при нагревании, взаимодействует с кислотами и со щелочами (записываются уравнения реакций в ионном и молекулярном виде).
Генетический ряд алюминия
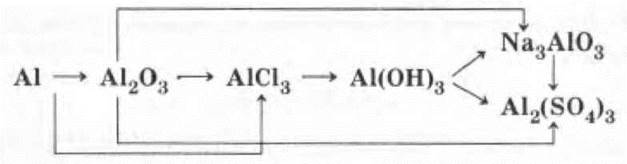
Учитель предлагает проиллюстрировать схему уравнениями реакций в ионной (там, где это имеет место) и молекулярной формах, а также разобрать все окислительно-восстановительные реакции.
Решается задача.
В соляной кислоте растворили 270 г алюминия, содержащего 10% примесей. Какой объем водорода (н. у.) получили при этом, если выход его составляет 75% от теоретически возможного? Сколько граммов 20% -ной НСl потребовалось для реакции?
III. Зависимость характера оксида и гидроксида переходного металла от с. о. элемента
Этот материал предназначен для учащихся «сильных» классов и разбирается по учебнику (с. 10) для соединений хрома.