Настольная книга учителя по химии 9 класс - поурочные разработки
Спирты - Органические вещества
Цели урока. На примере реакции гидратации алкенов познакомить учащихся с предельными одноатомными спиртами, их свойствами, получением и применением. Дать понятие об атомности спиртов и на этой основе дать представление о двух- и трехатомных спиртах и их значении.
Оборудование и реактивы. Этиловый спирт, глицерин, медная проволока, растворы CuSO4 и NaOH, спиртовка. Демонстрационные образцы: автомобильный антифриз, модели молекул Стюарта—Бриглеба.
I. Предельные одноатомные спирты
Начать урок можно с краткого повторения пройденного с элементами нового материала. Учащиеся вспоминают определение предельных углеводородов и, изображают развернутую структурную формулу этана. Какое химическое свойство наиболее характерно для предельных углеводородов? Реакции замещения. Учитель просит написать реакцию хлорирования этана и для продукта реакции также написать развернутую структурную формулу. Параллельно учитель или кто-либо из учащихся иллюстрирует реакцию с помощью моделей молекул.

Путем замены одного или нескольких атомов водорода в молекуле на другие атомы или группы можно получить соединения других гомологических рядов, других классов. Если подействовать на хлорэтан водным раствором щелочи, атом хлора заместится на группу —ОН, называемую гидроксильной группой.
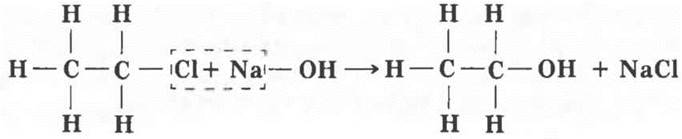
Получилось соединение состава СН3—СН2—ОН. Учащиеся вспоминают, что уже встречались с этим веществом, оно называется этиловый спирт цли этанол. Его также можно получить присоединением воды к этилену:
![]()
Этиловый спирт известен человеку с древности. Приготавливать спиртные напитки люди умели еще за 4 тыс. лет до н. э. Их действующее начало — этиловый (или винный) спирт — получалось иным путем, а именно брожением сахаристых веществ. В виноградном соке содержится глюкоза (виноградный сахар) С6Н12O6, придающая ягодам сладкий вкус. Под действием микроорганизмов происходит процесс, называемый брожением:
![]()
Слово алкоголь впервые применил для названия этилового спирта средневековый врач и естествоиспытатель Парацельс. Это слово происходит от арабского al-kohol, что означает одурманивающий. В XIX в. этим термином стали называть все аналоги этанола. Синтетическим путем этиловый спирт впервые получил в 1828 г. Майкл Фарадей, использовав взаимодействие этилена с водой в присутствии серной кислоты.
Учитель кратко характеризует физические и химические свойства этилового спирта, сопровождая рассказ демонстрацией растворимости вещества в воде, его способности растворять органические вещества летучести, горения.
При горении этилового спирта выделяется большое количество теплоты. Это вещество рассматривается как альтернативное бензину экологически чистое топливо для двигателей внутреннего сгорания.
![]()
Уже нередко на дорогах Бразилии, Мексики, некоторых других стран можно встретить машины, в которых в качестве топлива используют смесь бензина с этиловым спиртом. Этот своеобразный коктейль, как показали исследования, заметно уменьшает содержание опасных для здоровья примесей в выхлопных газах. В отличие от чистого спирта такая смесь не требует переделки мотора машины, до этого «питавшейся» только бензином.
Этиловый спирт — основа ликероводочного производства. Для пищевых целей используют спирт, полученный не синтетическим путем, а брожением сахаристых веществ. Здесь для учителя появляется очень своевременная возможность провести антиалкогольную пропаганду. Мы поднимаем бокалы за здоровье, однако многие потребляют гораздо больше спиртного, чем это допустимо с медицинской точки зрения. Согласно последним данным 40 г чистого алкоголя — это доза, которую не следует превышать даже взрослому здоровому мужчине. Женщинам следует ограничиваться 20 г.
При злоупотреблении алкоголем более других органов страдает печень, так как именно она отвечает за расщепление этанола. Спиртным вызвано более половины случаев воспаления поджелудочной железы (панкреатит). Спирт раздражает слизистую желудка и способен повредить ее. Постоянное употребление алкоголя ведет к нарушениям обмена в организме почти всех витаминов и тем самым к их дефициту и .ослаблению иммунитета.
Этиловый спирт является наркотиком. Он дополнительно возбуждает систему мозгового ствола, отвечающую за наше самочувствие и эмоции. Наступает привыкание, и человек все чаще и чаще нуждается в стимуляции этой системы извне, тем самым еще сильнее повреждая ее. Получается замкнутый круг. Полагая, что он контролирует ситуацию, пьющий человек подвергает риску свое здоровье, психику, наследственность и даже социальное положение.
Помимо того что сам этиловый спирт оказывает вредное воздействие на внутренние органы, токсичны и продукты его химических превращений в организме, в первую очередь — уксусный альдегид. Частично этанол превращается в это вещество уже в желудке. В промышленности же окисление спиртов до альдегидов является очень важным химическим производством. Учитель изображает на доске уравнение реакции и объясняет, что под действием окислителя (обозначенного условно [О]) молекула спирта теряет два атома водорода, образуется двойная связь между атомами углерода и кислорода. Эту реакцию можно считать качественной на метанол и его гомологи.
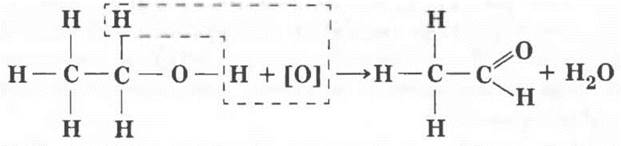
Образующееся вещество содержит новую функциональную группу атомов, определяющих его химические свойства. Соединения этого класса — предмет рассмотрения следующего урока. Очень эффектен эксперимент по окислению этилового спирта нагретым оксидом меди (II), описанный в учебнике. Его может провести и учитель, и учащиеся в рамках небольшой лабораторной работы.
Учитель обращается к классу: «Существует ли гомологический ряд, представителем которого является этиловый спирт?» Очевидно, да, причем этанол не является в нем первым. «Обратным действием» (уменьшением формулы на группу СН2 атомов) учащиеся восстанавливают формулу метилового спирта — СН3ОН. Прослеживается закономерность в номенклатуре спиртов: к названию алкана с тем же числом углеродных атомов добавляется родовой суффикс -ол. Второй вариант названия — наименование радикала, связанного с гидроксильной группой, с добавлением слова спирт (этиловый спирт, метиловый спирт).
Впервые метиловый спирт был получен при сухой перегонке древесины (нагревание без доступа воздуха с конденсацией образующихся газообразных веществ). В 1834 г. Жан Батист Дюма, французский химик, установил формулу «древесного спирта», а 25 лет спустя его соотечественник Марселей Бертло получил метанол синтетическим путем.
Химические свойства метанола схожи со свойствами этанола, что справедливо для представителей любого гомологического ряда. Учитель просит написать уравнение реакции окисления метилового спирта до соответствующего альдегида (его называют формальдегид или муравьиный альдегид), реакцию горения метанола:
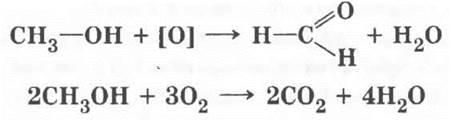
Учащимся третьего уровня вполне под силу вывести общую формулу спиртов: СnН2n+1OH.
Метанол очень ядовит, является нервно-сосудистым ядом, его доза в 50 г смертельна для человека. Но даже меньшие количества этого спирта поражают зрительный нерв и сетчатку глаза, наступает слепота. В промышленности метиловый спирт служит сырьем для получения формальдегида, используется в производстве синтетических волокон (лавсан), является прекрасным растворителем.
II. Многоатомные спирты
Переходя ко второй части урока, учитель просит ребят вспомнить и написать реакцию окисления этилена водным раствором перманганата калия.

Можно ли назвать образующийся продукт спиртом? Да, можно, но только такие спирты, содержащие две гидроксильные группы, называют двухатомными в отличие от спиртов ряда метанола — одноатомных.
Учитель характеризует физические свойства этиленгликоля и демонстрирует качественную реакцию на многоатомные спирты с гидроксидом меди (II) (одноатомные в эту реакцию не вступают!). Уравнение реакции писать нецелесообразно, оно слишком сложно для запоминания в 9 классе.
Теперь интересно сравнить окраску полученного раствора с окраской автомобильного антифриза из демонстрационного набора на столе. Вывод очевиден. Охлаждающая жидкость, не замерзающая на морозе, — это водный раствор этиленгликоля с добавкой соединений меди (присадки), защищающий детали двигателя машины от коррозии. Помимо антифризов, этиленгликоль используется в производстве очень распространенного в быту полимера — полиэтилентерефталата (ПЭТ). Из него изготавливают знакомые всем лимонадные бутылки. Следует помнить, что этиленгликоль очень ядовит!
Существуют ли спирты, содержащие три гидроксильные группы, то есть трехатомные спирты? Да, только гидроксильные группы должны быть связаны с разными углеродными атомами. Следовательно, простейший трехатомный спирт содержит три атома углерода и три гидроксильные группы. Заполнив оставшиеся валентности углерода водородными атомами, учащиеся выводят структурную формулу глицерина:
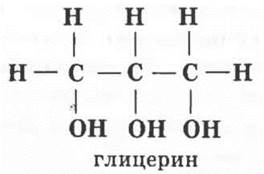
Глицерин открыл знаменитый шведский химик Карл Шееле в 1779 г. Однажды он изготавливал мазь, нагревая оливковое масло с кислотой. Мазь оказалась сладкой на вкус. Шееле повторил опыт и выделил желтоватую вязкую жидкость, которую назвал масляный сахар — глицерин (от греческого глюкос — сладкий).
Учитель демонстрирует учащимся глицерин и характеризует его физические свойства. Показывает растворимость глицерина в воде.
Ребятам предлагается ответить на вопрос: с каким из спиртов более схожи химические свойства глицерина — этиловым или этиленгликолем? Обычно ответ безошибочен, поскольку глицерин — тоже многоатомный спирт. Следовательно, он должен давать качественную реакцию с гидроксидом меди (II), что и демонстрируется на опыте.
В отличие от этиленгликоля глицерин не токсичен. Его даже добавляют в напитки для придания тягучести и сладкого вкуса. В промышленности глицерин используют для производства взрывчатых веществ, полимеров, антифризов. Свойство глицерина поглощать влагу воздуха, то есть смягчать смазанные им поверхности, широко используется для производства косметических препаратов, смазок, крема для обуви, мазей, при выделке кожи, тканей и бумаги.
Для закрепления изученного материала можно предложить учащимся решить следующие задачи.
1-й уровень
1. Запишите уравнения реакций, с помощью которых можно осуществить следующую цепочку превращений:
![]()
2. При взаимодействии этилена с водным раствором перманганата калия получили 12,4 г этиленгликоля. Какой объем этилена (н. у.) вступил в реакцию?
2-й уровень
1. Запишите уравнения реакций, с помощью которых можно осуществить следующую цепочку превращений:

2. Из 50 кг этилена за одно прохождение через реактор получается 36 кг этилового спирта. Рассчитайте массовую долю выхода продукта реакции.
3-й уровень
1. Запишите уравнения реакций, с помощью которых можно осуществить следующую цепочку превращений:
![]()
2. Сколько тонн спирта с массовой долей 96% можно получить гидратацией 1 т этилена?