Настольная книга учителя по химии 9 класс - поурочные разработки
Непредельные углеводороды. Этилен и его гомологи - Органические вещества
Цели урока. Дать представление о реакциях дегидрирования как основном способе получения алкенов из алканов и реакциях гидрирования как противоположном процессе. Познакомить с гомологическим рядом алкенов, их представителями, свойствами и применением. Развить понятие изомерии на примере этого класса углеводородов, равно как и номенклатуру их.
Оборудование и реактивы. Этиловый спирт, H2SО4 (конц.), кипелки (прокаленный песок или кусочки пемзы, битого фарфора), бромная вода или настойка иода, раствор КМnO4, светлое растительное масло. Демонстрационные образцы: изделия из полиэтилена (пленка, предметы быта), модели молекул Стюарта—Бриглеба.
I. История открытия непредельных углеводородов
На предыдущем уроке учащиеся выяснили, что предельные углеводороды широко распространены в природе. Но это не единственный класс веществ, которые могут образовывать углерод и водород. В 1669 г. немецкий ученый Иоганн Иохим Бехер, нагревая этиловый спирт с серной кислотой, получил неизвестный ранее газ, названный «газ Бехера». Новый газ отличался по свойствам от известного в то время болотного газа: горел ярким светящимся пламенем, легко присоединял различные вещества.
Открытие Бехера не привлекало внимания ученых более 100 лет, и только в 1795 г. голландский химик И. Дейман подробно изучил «газ Бехера». Он установил, что он состоит из углерода и водорода, а при взаимодействии с хлором превращается в маслянистую жидкость (1,2-дихлорэтан). Так произошло название олефин, что значит маслородный. В дальнейшем все углеводороды, подобные «газу Бехера», стали называть олефиновыми, а сам газ — этиленом.
II. Строение и гомологический ряд этиленовых углеводородов
Установить строение этилена удалось только в 1860 г. А. М. Бутлерову. Он синтезировал этилен другим способом и установил, что в его молекуле на два атома углерода приходится четыре атома водорода. В соответствии с формировавшейся тогда теорией химического строения нельзя было изобразить структурную формулу этилена, не нарушив валентности атомов. Ведь свободных валентностей у атомов в молекуле быть не должно! На помощь приходит гениальная догадка: атомы углерода связаны не одной, а двумя валентностями.
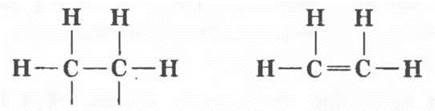
Вооруженные теорией химического строения в 60—70-е гг. XIX в. химики одно за другим синтезировали все новые и новые углеводороды с двойной связью. Эти исследования связаны с именами замечательных русских ученых: А. М. Бутлерова, Ф. М. Флавицкого, А. П. Эльтекова.
Аналогично предельным углеводородам соединения с двойной углерод-углеродной связью образуют свой гомологический ряд, родоначальником которого является этилен (международное название — этен) СН2=СН2.
Этиленовыми (олефиновыми) углеводородами, или алке- нами, называются углеводороды, содержащие в молекуле одну двойную углерод-углеродную связь С—С.
Поскольку валентности атома углерода не до предела насыщены атомами водорода, такие углеводороды часто называют непредельными.
Вторым представителем ряда будет углеводород с тремя углеродными атомами — пропилен (или пропен) CH2=CH—CH3.
Учитель ставит вопрос: как отличается состав этиленового углеводорода от состава предельного с тем же числом углеродных атомов?
На примерах этена и пропена можно прийти к выводу, что алкен содержит на два атома водорода меньше соответствующего алкана, следовательно, общая формула этиленовых углеводородов СпН2n:
![]()
(реакция дегидрирования)
Теперь легко составить молекулярные формулы любого представителя гомологического ряда:
С4Н8 — бутилен (или бутен), С5Н10 — амилен (или пентен).
Учитель обращает внимание на то, что гомологическая разность —СН2— сохраняется и в этом ряду. Учащиеся легко приходят к выводу, что в названии этиленового углеводорода суффикс -ан соответствующего алкана заменяется на -ен или -илен:
Алкан → алкен + Н2
(дегидрирование)
III. Изомерия и номенклатура этиленовых углеводородов
Учитель просит ребят вспомнить определение явления изомерии и пояснить его на примере бутана. На доске изображает структурные формулы обоих изомеров и называет их.
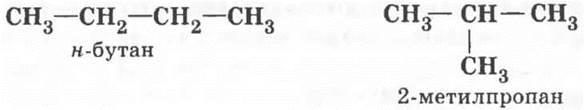
Бутен отличается от бутана наличием в молекуле двойной связи. Ее можно ввести в молекулу вместо двух водородных атомов. Структура н-бутана позволяет сделать это двумя способами: расположить двойную связь между первым и вторым или между вторым и третьим углеродными атомами цепи. Обычно возникает вопрос о «третьем» возможном положении ![]() С помощью моделей молекул нужно продемонстрировать его идентичность первому варианту. Структура 2-метилпропана позволяет превратить его в этиленовый углеводород лишь одним способом (все метильные группы эквивалентны между собой). Таким образом, получились по крайней мере три изомерных бутена:
С помощью моделей молекул нужно продемонстрировать его идентичность первому варианту. Структура 2-метилпропана позволяет превратить его в этиленовый углеводород лишь одним способом (все метильные группы эквивалентны между собой). Таким образом, получились по крайней мере три изомерных бутена:
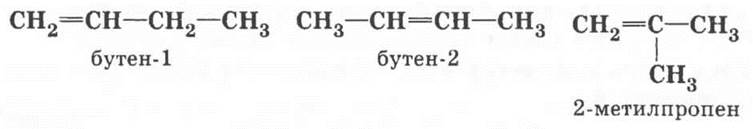
Упоминать о пространственной изомерии алкенов в 9 классе нецелесообразно. Полученные структуры отличаются не только строением углеродной цепи, но и расположением двойной связи. Это новый тип изомерии, который приводит к появлению большего числа изомеров у этиленовых углеводородов по сравнению с парафиновыми.
В названиях соединений этиленового ряда также появляется новшество: необходимо указывать положение двойной связи в цепи. С этой целью в конце названия после дефиса обозначается номер углеродного атома, от которого начинается двойная связь.
Для закрепления данного фрагмента материала учитель может предложить несложные задания, например:
1. Выпишите отдельно формулы предельных и этиленовых углеводородов и назовите вещества: С5Н10, С2Н2, СН4, С2Н6, С3Н4, C4H10, С2Н2, C6H6.
2. Напишите уравнения реакции получения 2-метилпропена из 2-метилпропана.
3. Изобразите структурные формулы трех изомеров и одного гомолога н-пентена, назовите вещества.
IV. Получение и свойства этиленовых углеводородов
Получить этиленовые углеводороды можно не только реакцией дегидрирования алканов. Этот способ неприменим в лабораторных условиях из-за жестких условий протекания реакции. Учитель напоминает, что впервые этилен был получен взаимодействием этилового спирта с концентрированной серной кислотой. В этой реакции соседние атомы углерода теряют атом водорода и группу —ОН (гидроксильная группа), освобождают по одной валентности, с помощью которых образуют вторую химическую связь.

После записи определения реакции дегидратации учитель демонстрирует получение этилена нагреванием смеси этанола с концентрированной серной кислотой. Газоотводную трубку опускают в пробирку с водой: учащиеся отмечают, что выделяющийся газ нерастворим в воде. Газоотводную трубку поочередно опускают в пробирки с бромной или йодной водой (1—2 каплями настойки йода в воде) и подкисленным раствором перманганата калия. Оба раствора обесцвечиваются. В заключение опыта этилен поджигают, ребята наблюдают цвет пламени, сравнивая его с пламенем газовой зажигалки.
При записи уравнений химических реакций на доске учитель подчеркивает, что для непредельных углеводородов характерны реакции присоединения и окисления в отличие от предельных углеводородов, склонных к реакциям замещения. Особенно следует обратить внимание на реакцию галогенирования. И алканы, и алкены с бромом и хлором реагируют, но условия реакции, ее тип, структура конечных продуктов различны!
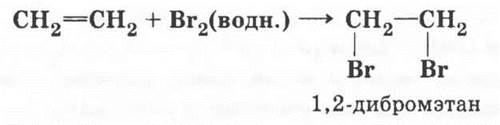
В уравнении взаимодействия этилена с перманганатом калия окислитель лучше изображать символом [О], не вдаваясь в детали побочных продуктов реакции:

Если нет возможности получить этилен, учитель может продемонстрировать реакции присоединения и окисления веществ с двойной связью (обычного растительного масла, желательно светлого). Ребятам необходимо пояснить, что молекулы этого природного вещества также содержат двойную углерод-углеродную связь, которая сохраняет свои свойства в реакциях окисления и присоединения. Встряхивание пробирок с бромной водой и раствором КМnO4 с добавлением нескольких капель масла очень эффектно демонстрирует исчезновение окраски. Этот опыт полезен и с методической точки зрения: обесцвечивание растворов Вr2 и КМnO4 является качественной реакцией на кратную связь (двойную или тройную), в каких бы молекулах она ни содержалась.
Третье характерное для этиленовых углеводородов химическое свойство — реакции полимеризации.
В 70-х гг. XIX в. А. М. Бутлеров обнаружил, что молекулы этилена способны соединяться друг с другом, образуя димеры и тримеры. Увеличив температуру и давление, можно заставить присоединиться друг к другу сотни и тысячи молекул. Учитель дает определение реакций полимеризации, понятий мономер и полимер.
В 1938 г. в России (тогда — в Советском Союзе) вступил в строй первый завод по производству полиэтилена. Началась эра победоносного шествия синтетических полимеров, вытеснивших природные материалы из большинства сфер жизнедеятельности человека.
Последняя реакция присоединения, заслуживающая внимания, — гидратация алкенов. Учитель объясняет ее на примере этилена. Любая реакция присоединения заключается в разрыве одной из двух связей между атомами углерода, в результате которой к образовавшимся свободным валентностям присоединяются два фрагмента реагента. Так происходит и в случае присоединения воды:
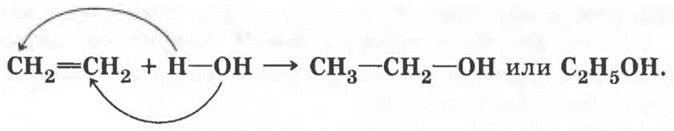
Эта реакция — мостик к новому классу органических соединений, рассмотрению которых будет посвящен следующий урок.
V. Применение этиленовых углеводородов
Ввиду своей высокой химической активности этиленовые углеводороды практически не встречаются в природе. По той же причине они являются очень ценным сырьем для химической промышленности.
Присоединением воды, галогенов, галогеноводородов к алкенам получают спирты и галогенпроизводные, используемые в качестве растворителей, хладагентов, анестезирующих средств.
Окислением этилена и пропилена перманганатом калия получают двухатомные спирты: этиленгликоль и пропиленгликоль. Водные растворы этих веществ имеют низкую температуру замерзания и используются в качестве охлаждающих жидкостей-антифризов (автомобильный тосол представляет собой 55%-ный водный раствор этиленгликоля с незначительным количеством добавок — присадок).
Однако наибольшее значение низшие непредельные углеводороды и их галогенопроизводные имеют для синтеза полимеров. Всем хорошо известны такие материалы, как полиэтилен, полипропилен (канаты, веревки, мочалки, «хрустящие» пакеты и упаковка, белые сахарные мешки), поливинилхлорид (изолента, изоляция проводов), политетрафторэтилен или тефлон (шайбы, втулки, подшипники, химически стойкая посуда).