Химия - учебно-практический справочник
Общая химия - Основные химические понятия. Вещество
Вещество — это то, из чего состоит физическое тело (вода, железо, соль, уголь и т.д.).
Физическим телом называется все, что имеет массу и объем (капля воды, яблоко, книга и т.д.).
Вещества, которые используют для изготовления предметов, оборудования, а также в строительстве и других отраслях, называют материалами (стекло, металл, камень, глина и др.).
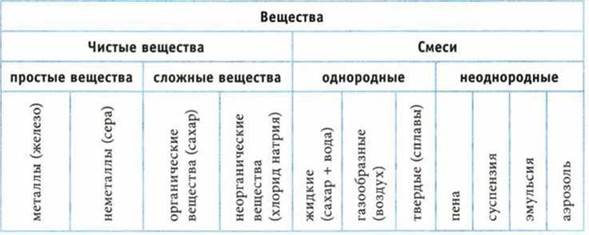
Преобладающее большинство чистых веществ состоит из мельчайших, механически неразделимых однотипных частиц — молекул.
Молекула — мельчайшая частица вещества, которая соответствует по составу данному веществу, сохраняет и определяет его химические свойства. Многие вещества состоят не из молекул, а из атомов или заряженных частиц — ионов. Атом — мельчайшая химически неделимая частица химического элемента, носитель всех его свойств.
Химический элемент — совокупность атомов определенного типа, которые имеют одинаковый заряд ядра и одинаковый номер в периодической таблице Д. И. Менделеева.
Ионы — электрически заряженные частицы, образовавшиеся из атомов (или групп атомов) вследствие потери или присоединения электронов. Положительно заряженные ионы называют катионами, отрицательно заряженные — анионами.
Химическая формула — запись атома, молекулы, иона, вещества с помощью символов химических элементов и индексов. Количество атомов каждого элемента обозначают в формуле с помощью нижнего индекса, а заряд иона — верхнего.
Формульная единица — частица или совокупность частиц вещества, выраженная ее химической формулой.
Химическая формула отображает качественный и количественный состав частицы или вещества.
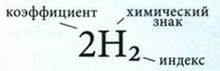
При характеристике качественного состава называют элементы, которые образуют частицу или вещество. При характеристике количественного состава указывают количество атомов каждого элемента в молекуле или сложном ионе, соотношение атомов разных элементов или ионов в веществе.
Валентность — способность атома соединяться с определенным количеством таких же или других атомов.
· Валентность водорода и фтора равна I.
· Валентность кислорода равна II (в большинстве случаев).
· Валентность элементов Iа, IIа групп и алюминия равна номеру группы.
· Валентность группы (ОН) равна I.
· Валентность кислотного остатка равна количеству атомов водорода в кислоте.
Составление формул веществ по валентности
Бинарные соединения, основные состояния
|
1. Записываем рядом символы химических элементов, например серы и кислорода |
SO |
|
2. Расставляем валентности над символами химических элементов |
|
|
3. Находим наименьшее общее кратное (НОК) |
|
|
4. Делим НОК на валентность элементов и находим число атомов элементов (индексов) в соединении. Индекс 1 не пишем |
SO НОК = 6 6 : 6 = 1 (S) 6 : 2 = 3 (О) формула SO3 |
Многоэлементные соединения
|
1. Записываем рядом химический символ металла (например Аl) и кислотный остаток сульфатной кислоты (SO4) |
AlSO4 |
|
2. Расставляем над символами химического элемента и кислотным остатком сульфатной кислоты валентности |
|
|
3. Находим НОК |
3 ∙ 2 = 6; НОК = 6 |
|
4. Делим НОК на валентности и находим индексы |
6 : 3 = 2 (Al) 6 : 2 = 3 (SO4) формула Al2(SO4)3 |
Формулы бывают:
· химические H2O; HCl
· графические (структурные) 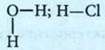
Физические и химические явления
Физическое явление — изменение физических свойств веществ (агрегатного состояния, плотности, электро- и теплопроводности); новое вещество не образуется.
Химическое явление — химическая реакция, при которой образуется новое вещество.
Признаки химических реакций:
· изменение цвета;
· появление запаха;
· выделение газа;
· образование осадка;
· выделение или поглощение теплоты.
Относительная атомная масса (Аr) — физическая величина, которая определяется отношением массы атома элемента к 1/12 части массы атома углерода:
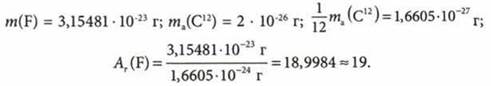
Относительная молекулярная масса вещества (Мr) — физическая величина, которая равна отношению массы молекулы вещества к 1/12 части массы атома углерода:
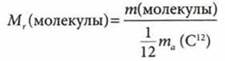
Относительная молекулярная (формульная) масса Мr равна сумме относительных масс атомов элементов Аr, которые входят в состав молекулы или формульной единицы, с учетом числа атомов элементов:
![]()
где (X) — химическое вещество; n — число атомов химических элементов; Е1, E2, Е3 — химические элементы.
Например: ![]()
Массовая доля элемента (w) — отношение массы элемента к общей массе молекулы:
![]()
где Аr(Е) — относительная атомная масса элемента, n(Е) — количество атомов элемента в данном веществе, Мr(х) — относительная молекулярная масса вещества х. Величина w не имеет размерности. Ее часто выражают в процентах:
![]()
Молярная масса вещества (М) — физическая величина, равная отношению массы вещества (m) к соответствующему количеству вещества (v):
![]()
Молярная масса — масса 1 моль вещества.
М(С) = 12 г/моль; М(O2) = 16 ∙ 2 = 32 г/моль.
Молярный объем (VM) — объем 1 моль вещества.
![]()
где М — молярная масса вещества; ρ — плотность вещества; VM — молярный объем вещества.
Ученые установили, что Ум различных газов при одинаковых условиях составляет 22,4 л/моль. Нормальные условия (н. у.): 0°С, 101,3 кПа, или 760 мм рт. ст., или 1 атм.
1 моль любого газа при нормальных условиях занимает объем 22,4 л. Для газов при н. у. VM = 22,4 л/моль.
Молярный объем — отношение объема к количеству вещества:
![]()
где v — количество вещества, V — объем вещества.
Закон Авогадро. В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие из закона Авогадро: два различных газа одинаковых объемов при одинаковых условиях содержат одинаковое количество вещества (число молекул), но имеют разные массы, т.е. плотности газов относятся как их относительные молекулярные массы:
![]()
где Na — число Авогадро (постоянная Авогадро).
Средняя относительная молекулярная масса воздуха Мг равна 29.
Относительная плотность газа (D) — отношение массы одного газа к массе другого газа такого же объема (не имеет размерности):
![]()
Плотность газа В по воздуху:
![]()
В 1811 г. итальянский физик Амедео Авогадро (1776-1856) сформулировал закон, который ввел в науку представление о молекулах как мельчайших частицах вещества. Ученый особо подчеркивал, что молекулы простых веществ отнюдь не должны быть подобны атомам, наоборот, они, как правило, состоят из нескольких одинаковых атомов. Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов.
ПРОВЕРЬТЕ СЕБЯ
1. Составьте формулы соединений по значению валентности элементов.
![]()
2. Запишите графические формулы молекул SO2, PH3, Сl2O, НВr, Н2СO3.
3. Определите валентность элементов в соединениях, имеющих следующие формулы: СаН2, SiF4, Li3P, CuS, Ca3N2, P2O5, Mn2O7.
4. Приведенные химические формулы и знаки химических элементов разместите в таблице. Укажите, в каких случаях углерод, кислород и сера будут элементами, в каких — простыми веществами.
Н2O, FeS2, O2, СO2, СН4, SO2, H2S, С, К2O, S, С2Н2, CS2.
5. Запишите формулу вещества, если известно, что оно состоит из кальция и серы, а его количественный состав 1 : 1. Вычислите относительную молекулярную массу вещества.
6. Вычислите массовые доли элементов в метане СН4.
7. Определите валентность элементов по графическим формулам и запишите их химические формулы.
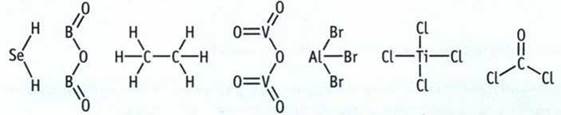
8. Определите массовые доли элементов в оксиде меди(I) и оксиде меди(II). Найденные массовые доли выразите в процентах.
9. Расположите формулы соединений в порядке возрастания по содержанию в них железа: Fe3O4, Fe(OH)3, FeSO4, FeO, Fe2O3.
10. Массовая доля серы в оксиде равна 0,4. Определите формулу оксида.
11. Состав оксида элемента выражен простой формулой X02. Известно, что для получения оксида массой 22,2 г нужен элемент массой 15,8 г. Какой элемент образует оксид?
12. Вычислите объем, которые занимает при нормальных условиях сероводород массой 170 г.
13. Определите массу и объем, которые при нормальных условиях занимают 3,01 ∙ 1023 молекул оксида углерода.
14. Один литр некоторого газа при нормальных условиях имеет массу 1,96 г. Какова относительная плотность этого газа по азоту?
15. Плотность галогеноводорода по воздуху равна 2,8. Определите плотность этого газа по водороду и назовите его.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите химическое явление.
А кипение воды
Б плавление железа
В прогоркание сливочного масла
Г таяние льда
2. Укажите физические явления.
А образование облаков
Б плавление олова
В скисание вина
Г гниение листьев
Д кипение воды

3. Относительную молекулярную массу рассчитывают по
А массе молекулы
Б химической формуле молекулы
В массе атомов, входящих в состав молекулы
Г относительной атомной массе элементов
4. Укажите относительную формульную массу иона калия К+.
А 37
Б 38
В 39
Г 40
5. В каком соединении валентность серы равна VI?
A H2S
Б SO2
B CS2
Г SO3
6. Установите соответствие между веществом и физическим телом.
Вещество Физическое тело
1 серебро А книга
2 ртуть Б термометр
3 бумага В кольцо
4 стекло Г витрина
Д яблоко
7. Установите соответствие между веществом и его определением.
1 графит А органическое вещество
2 кислород Б неорганическое вещество
3 халькозин (медная руда)
4 глюкоза
5 молочная кислота
8. Установите соответствие между явлением и его названием.
1 отвердевание расплавленного парафина А химическое явление
2 подгорание пищи на сковороде Б физическое явление
3 образование соли при испарении морской воды
4 взрыв динамита
9. Установите соответствие между символом элемента и его простым веществом.
Символ элемента Простое вещество
1 Аg А золото
2 Аи Б серебро
3 Fe В ртуть
4 Нд Г железо
Д медь
10. Установите соответствие между формулой соединения и его строением
Формула соединения Строение соединения
1 SiО2 А атомное
2 Na2CО3 Б молекулярное
3 С12Н22О11 В ионное
4 СО
11. Что является формульной единицей для кальцинированной соды Na2CО3?
А 5 ионо.
Б 4 иона
В 2 иона
Г 3 иона
12. Валентность кислорода —
А I
Б II
В III
Г IV
13. Водород и фтор всегда имеют валентность
А VII
Б I
В II
Г III
14. В каком соединении валентность хлора равна I?
А Сl2O7
Б Сl2O
В СlO2
Г Сl2O3
15. Относительная молекулярная масса серной кислоты равна
А 82
Б 62
В 98
Г 78