Химия - учебно-практический справочник
Химическая реакция - Общая химия
Пример схемы реакции с дополнительными обозначениями и названиями веществ:
![]()
Комментировать ее надо так: при нагревании мела образуются негашеная известь и углекислый газ.
Схема реакции позволяет сделать вывод: все атомы химических элементов во время реакции сохраняются.
М. В. Ломоносов и А. Л. Лавуазье открыли закон сохранения массы веществ при химической реакции: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате этой реакции.
Химическое уравнение — запись химической реакции с помощью формул реагентов и продуктов, соответствующая закону сохранения массы веществ.
![]()
Такие записи называют химическими уравнениями.
Типы химических реакций
I. По количеству реагентов и продуктов
1. Соединения:
![]()
(из двух или более веществ образуется одно новое вещество).
2. Разложения:
![]()
(из одного вещества образуются два или более новых веществ).
3. Обмена:
![]()
(два вещества обмениваются своими составными частями, образуя два новых вещества).
4. Замещения:
![]()
(реакции между простым и сложным веществами, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества, образуя новые вещества — одно простое и одно сложное).
II. По изменению степени окисления элементов
1. Окислительно-восстановительные:
![]()
(происходят с изменением степеней окисления элементов реагирующих веществ).
2. Реакции не окислительно-восстановительные:
![]()
(происходят без изменения степеней окисления элементов реагирующих веществ: реакции обмена, большинство реакций соединения и разложения).
III. По тепловому эффекту
1. Экзотермические:
![]()
(происходят с выделением теплоты (∆Н < О, Q > 0)).
2. Эндотермические:
![]()
(происходят с поглощением теплоты (∆Н > 0, Q < 0)).
IV. По направлению течения
1. Обратимые:
![]()
(протекают в двух противоположных направлениях одновременно при одних и тех же условиях).
2. Необратимые:
![]()
(протекают только в одном направлении).
Внешние эффекты, сопровождающие химические реакции
а) образование осадка: ![]()
б) выделение газа: ![]()
в) изменение окраски: ![]()
г) появление запаха: ![]()
д) выделение теплоты: ![]()
е) выделение теплоты и света: ![]()
Теория окислительно-восстановительных реакций
Атомы, молекулы или ионы, отдающие электроны и подвергающиеся окислению, называются восстановителями, а сам процесс отдачи электронов — окислением.
Например: ![]()
Атомы, молекулы или ионы, которые присоединяют электроны и восстанавливаются, называются окислителями, а сам процесс присоединения электронов — восстановлением.
Например: ![]()
Восстановитель ![]() Окислитель; Окислитель
Окислитель; Окислитель ![]() Восстановитель.
Восстановитель.
Признаки окислительно-восстановительных реакций
1) Степень окисления элемента в простых веществах равна нулю, а в соединении (оно образуется в результате реакции) является положительным или отрицательным числом.
2) Процессы окисления и восстановления всегда сопровождают друг друга. Сколько электронов теряют одни частицы, столько электронов присоединяют другие. Теорию окислительно-восстановительных реакций в 1914 г. предложил Л. В. Писаржевский.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса

Проверку правильности написания уравнения можно ограничить подсчетом количества атомов одного какого-либо элемента, например водорода или кислорода.
Ж. Гей-Люссак в 1808 г. открыл закон объемных соотношений газов: объемы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как простые целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Скорость химической реакции определяется изменением концентрации реагирующих веществ (или продуктов реакции) за единицу времени.
Реакции в однородной среде называют гомогенными, а в неоднородной (между газом и твердым телом) — гетерогенными.
Скорость гомогенной реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объема:
![]()
где ∆v = v1 - v2 — изменение количества вещества, V — объем системы (раствора, смеси реагирующих веществ), ∆t — интервал времени.
Единица измерения — моль/л ∙ с или моль/м3 ∙ с.
Скорость гетерогенной реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени на единице поверхности разделения фаз: ![]() где S — площадь разделения фаз.
где S — площадь разделения фаз.
Скорость химической реакции зависит от различных факторов:
1) для веществ в жидкой и газовой фазах v реакции — от концентрации реагирующих веществ. Например, реакция окисления оксида азота(II) чистым кислородом происходит быстрее, чем реакция окисления кислородом воздуха:
![]()
2) реакции в твердой фазе происходят быстро, если реагирующие вещества находятся в порошкообразном состоянии. Так, сахар горит только в пламени, а сахарная пудра загорается от искры;
3) от температуры: с повышением ее на 10 °С v реакции увеличивается в 2-4 раза;
4) на v реакции влияют катализаторы:
![]()
Ломоносов Михаил Васильевич (1711-1765) — выдающийся русский ученый. Разработал корпускулярную теорию строения вещества, предсказал возникновение современного атомно-молекулярного учения, считал своей главной профессией химию. По настоянию Ломоносова и по его проекту в 1755 г. открыт первый в России Московский университет, который впоследствии стал одним из центров российского образования и науки.
Писаржевский Лев Владимирович (1874-1938) — ученый и педагог. Разработал основы электронной химии, согласно которой химические процессы обусловлены строением электронных оболочек атомов и молекул. Важнейшие его труды посвящены исследованию пероксидов и надкислот, разработке теории растворов, применению электронной теории в химии и разработке теории гальванических элементов.
Гей-Люссак Жозеф-Луи (1778-1850) — французский физик и химик. Установил элементарную природу щелочных металлов, серы, фосфора, иода. Изучал объемные соотношения газов в химических реакциях.
ПРОВЕРЬТЕ СЕБЯ
1. Расставьте коэффициенты в схемах реакций, определите типы реакций.
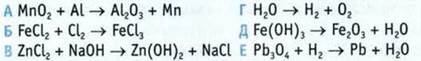
2. Составьте уравнения реакций, определите окислитель и восстановитель в окислительно-восстановительных реакциях.
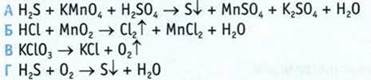
3. В какую сторону сместится химическое равновесие в системе
![]() при повышении концентрации аммиака?
при повышении концентрации аммиака?
![]() при повышении температуры?
при повышении температуры?
4. Кислород в лабораторных условиях добывают при нагревании перманганата калия. Составьте уравнение реакции разложения перманганата калия, применяя метод электронного баланса, подберите коэффициенты в уравнении этой окислительно-восстановительной реакции. Укажите окислитель и восстановитель.
5. Преобразуйте схемы реакций в химические уравнения и определите тип каждой реакции.

6. Приведите примеры образования углекислого газа в результате реакции
а) разложения
б) соединения
7. М. В. Ломоносов, проводя опыты со ртутью, установил, что от слабого нагревания ртути на воздухе образуется вещество желтого цвета — «ртутная окалина», как тогда ее называли. При сильном нагревании «ртутная окалина» разлагается на ртуть и кислород. Определите, о каких типах реакций писал М. В. Ломоносов, составьте уравнения этих реакций.
8. Как повлияет повышение давления на равновесие в системах?
![]()
9. Как нужно изменить температуру и давление (повысить или понизить), чтобы равновесие в реакции разложения карбоната кальция ![]() (∆Н0 = 178 кДж) сместилось в сторону продуктов разложения?
(∆Н0 = 178 кДж) сместилось в сторону продуктов разложения?
10. Как повлияет снижение давления на равновесие в реакциях?
![]()
11. Как повлияет снижение температуры на равновесие в системах?
![]()
12. Какие реакции из приведенных уравнений реакций являются окислительно-восстановительными?
![]()
13. Укажите восстановитель и окислитель в реакции 2КСlO3 = 2КСl + 3O2.
14. В каком из приведенных уравнений реакций оксид марганца(IV) проявляет свойства окислителя, а в какой — восстановителя?
![]()
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите пропущенный термин: «Химическое равновесие — это такое состояние обратимого процесса, когда ... прямой реакции равна ... обратной реакции».
А давлени.
Б температура
В концентраци.
Г скорость
2. Укажите реакцию соединения.
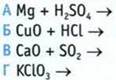
3. Укажите эндотермические реакции.
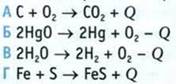
![]()
4. Укажите реакции, для которых увеличение давления системы вызывает смещение равновесия вправо.
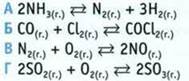
![]()
5. Укажите, в какой реакции при повышении температуры химическое равновесие сместится в сторону продуктов реакции.
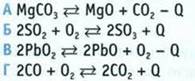
6. Укажите окислительно-восстановительные реакции.
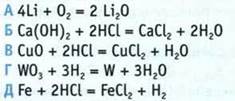
![]()
7. Установите соответствие между химическим уравнением и типом химической рекации.
Химическое уравнение
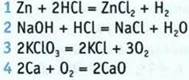
Тип химической реакции
А соединения
Б замещения
В обмена
Г разложения
Д с образованием осадка
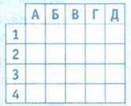
8. Установите последовательность размещения полусхем в порядке возрастания общей суммы коэффициентов.
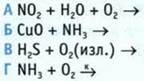
![]()
9. Установите соответствие между реагентами и признаками химических реакций.
Реагенты
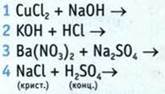
Признаки химических реакций
А образование бесцветного газа
Б образование голубого газа
В образование воды
Г образование белого осадка
Д образование синего осадка
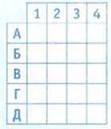
10. В каком из уравнений химических реакций смещение химического равновесия в сторону образования продуктов реакции обусловлено повышением давления?
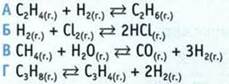
11. Какое из уравнений химической реакции относится к окислительно-восстановительным реакциям?
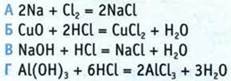
12. В каком из приведенных уравнений реакций соединение железа является окислителем?

13. Методом электронного баланса подберите коэффициенты в схеме окислительновосстановительной реакции. В ответе укажите коэффициенту восстановителя.
![]()
14. Используя метод электронного баланса, подберите коэффициенты в уравнении окислительно-восстановительной реакции: ![]() В ответе укажите количество отданных электронов.
В ответе укажите количество отданных электронов.
15. Подберите коэффициенты в схеме реакции: ![]() напишите уравнение химической реакции. В ответе укажите коэффициент у окислителя.
напишите уравнение химической реакции. В ответе укажите коэффициент у окислителя.