Химия - учебно-практический справочник
Соли - Основные классы неорганических соединений - Неорганическая химия
Соли — сложные вещества, состоящие из атомов металла и кислотного остатка (МmАn и Мm(ЕОn)р).
Соли — сложные вещества, образованные катионами металла и анионами кислотного остатка.
Типы солей
1. Средние: NaNO3, KF, Са3(РO4)2.
2. Кислые: NaHSO4, Ca(H2PO4)2.
3. Основные: Ca(OH)Cl, (CuOH)2SO4.
4. Двойные: KAl(SO4)2, KNaSO4.
5. Смешанные: Са(СlO)2, Al(NO3)Cl2.
6. Комплексные: K3[Al(OH)6].
Названия солей
СаСO3 — карбонат кальция, средняя соль.
Са(НСО3)2 — гидрокарбонат кальция, кислая соль.
Название средней соли состоит из названия металла и названия кислотного остатка. В названиях кислых солей используется приставка — гидро- с указанием числа атомов Н в молекуле соли.
Например:
Са(Н2РO4)2 — дигидрофосфат кальция.
Химические свойства средних солей
1. Взаимодействие с металлами. Более активные металлы вытесняют менее активные из растворов их солей (см. ряд стандартных электродных потенциалов):
![]()
2. Взаимодействие с кислотами:
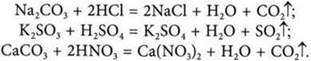
3. Взаимодействие со щелочами; образуются нерастворимые основания:
![]()
Способы получения средних солей
1. Взаимодействие кислот с основаниями:
![]()
2. Взаимодействие кислот с основными оксидами:
![]()
3. Взаимодействие кислот с металлами:
![]()
4. Взаимодействие кислотных оксидов со щелочами:
![]()
5. Взаимодействие солей с кислотами:
![]()
6. Взаимодействие солей со щелочами:
![]()
7. Взаимодействие основных и кислотных оксидов:
![]()
8. Взаимодействие солей с солями:
![]()
9. Взаимодействие солей с металлами:
![]()
10. Взаимодействие металлов с неметаллами:
![]()