Химия - учебно-практический справочник
Кислоты - Основные классы неорганических соединений - Неорганическая химия
|
Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться атомами металлов, и кислотных остатков |
|||
|
по составу |
по основности — числом атомов водорода |
классификация электролитов (кислот) в зависимости от степени диссоциации |
общая формула: НnE, НmEOn |
|
1) кислородсодержащие H2SO4, H2CO3 2) бескислородные НСl; HI |
1) одноосновные НВr, НСl 2) двухосновные H2S, Н2СО, 3) трехосновные Н3РO4 4) четырехосновные H4SiO4 |
1) сильные НСl, H2SO4, HNO, 2) средней силы HF, Н3РO4, H2SO, 3) слабые H2S, H2SiO3, H2CO3 |
НСl; НСlO4 |
Кислоты имеют химические и тривиальные названия
HCl — хлороводородная, соляная
HF — фтороводородная, плавиковая
H2S — сероводородная
HNO3 — азотная
H2SO4 — серная
Н2SO3 — сернистая
Н2СO3 — угольная
H2SiO3 — кремниевая
Н3РO4 — ортофосфорная, фосфорная
Химические свойства кислот
1. Взаимодействие с металлами. Кислоты реагируют с металлами, которые размещены в ряду стандартных электродных потенциалов слева от водорода (это реакция замещения), с выделением Н2:
![]()
2. Взаимодействие с основными оксидами:
![]()
3. Отношение к солям. Кислоты взаимодействуют с растворами солей, образованных более слабыми или более летучими кислотами:
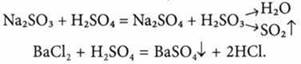
4. Взаимодействие с основаниями:
![]()
Получение кислот
1. Взаимодействие кислотных оксидов с водой:
![]()
2. Взаимодействие неметаллов с водородом:
![]()
Кислоты взаимодействуют с растворами солей, которые образованы более слабыми или более летучими кислотами. Сила кислот уменьшается в ряду: HF, НСlO4, HBr, НСl, H2SO4, HNO3,HMnO4, H2SO3, H3PO4, HJ, HNO2, H2CO3, H2S, H2SiO3.
![]()
Сильные кислоты взаимодействуют с растворами солей других сильных кислот, если в результате реакции обмена образуется нерастворимая соль.
![]()