Химия - учебно-практический справочник
Общие сведения о металлических элементах и металлах - Металлические элементы и их соединения. Металлы - Неорганическая химия
К металлическим элементам относятся все d- и f-элементы, s-элементы (кроме водорода и гелия) и несколько р-элементов.
Металлические элементы широко распространены в природе.
Атомы металлических элементов способны терять электроны и превращаться в катионы. Такая их способность возрастает с увеличением радиусов атомов: в периоде — справа налево, а в группе — сверху вниз.
Металлические элементы образуют простые вещества — металлы. Каждый атом в металле теряет один или несколько внешних электронов и превращается в катион. Такие электроны начинают хаотично двигаться в веществе, т. е. становятся делокализованными.
Связь между катионами в металле, осуществляемая с помощью делокализованных электронов, называют металлической.
Металлы — твердые вещества (исключение — ртуть), упругие, ковкие, прочные, непрозрачные, проводят электрический ток, имеют характерный блеск, высокую теплопроводность, большинство являются пластичными.
Металлы и их сплавы используют в химической промышленности, самолето- и машиностроении, технике, строительстве, монументальном искусстве, быту.
Химические свойства металлов
Металлы в химических реакциях являются восстановителями.
Активность металлов в химических реакциях, происходящих в водных растворах, определяется их положением в электрохимическом ряду напряжений (ряд активности металлов): Li, К,Cs, Rb, Ва, Sr, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Sb, Bi, Cu, Hg, Ag, Pt, Au.
Чем левее размещен металл в ряду напряжений, тем больше его химическая активность (восстановительная способность), когда он взят в виде простого вещества.
Чем активнее атомы ![]() тем ниже активность катионов Мn+.
тем ниже активность катионов Мn+.
1. Взаимодействие с водой. Щелочные и щелочноземельные металлы реагируют с водой при обычных условиях. Аналогичная реакция с участием магния происходит при нагревании:
![]()
Некоторые менее активные металлы взаимодействуют лишь с водяным паром при высокой температуре:
![]()
Малоактивны металлы, стоящие в ряду напряжений после (Н2), с водой не взаимодействуют:
![]()
2. Металлы взаимодействуют практически со всеми неметаллами (кроме инертных газов).
• с водородом: ![]()
• с галогенами: ![]()
• с углеродом: ![]()
• с кислородом: ![]()
• с серой: ![]()
3. Взаимодействие с кислотами. Металлы, расположенные слева от водорода в ряду активности металлов, взаимодействуют с кислотами: соляной НСl, ортофосфорной H3PO4, сернойH2SO4 (разбавленный раствор) с выделением водорода, а размещенные справа не реагируют с ними:
![]()
Окислителем в реакциях металлов с этими кислотами является ион водорода. Во время реакции металлов с нитратной и концентрированной серной кислотами водород не выделяется, а образуются другие вещества.
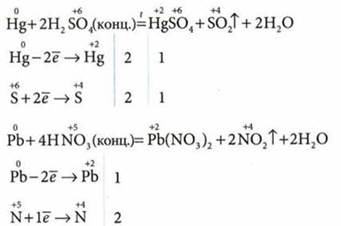
4. Реакции с растворами солей. Из растворов солей более активные металлы вытесняют менее активные:
![]()
Иногда в результате взаимодействия металла с солью образуются две новые соли:
![]()
5. Реакции со щелочами. Условия для реакции:
а) металл находится в ряду активности слева от водорода;
б) оксид, гидроксид соответствующего металлического элемента являются амфотерными:
![]()
Если взаимодействие происходит в водном растворе, то образуется комплексная соль:
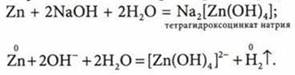
Способы получения металлов
1. Восстановление металлов из оксидов углеродом (коксом) или оксидом углерода(II):
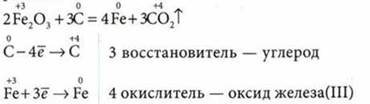
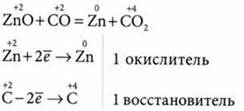
2. Восстановление металлов из их оксидов водородом:
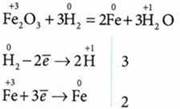
3. Металлотермия — восстановление металлов из их оксидов более активными металлами (обычно используют восстановление алюминием — алюмотермию):
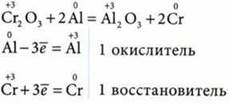
Химические основы производства чугуна
Чугун — сплав железа, в котором w(C) от 2 до 4,8%, a w(S, Р, Si и др. элементов) менее 8%.
Процесс производства чугуна основан на восстановлении соединений железа, содержащихся в рудах, до металла:
![]()
Стадии доменного процесса
1. Горение кокса и образование оксида углерода(II):
![]()
2. Восстановление железа оксидом углерода(II) и коксом:
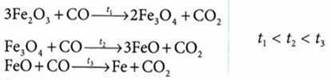
Кокс восстанавливает и примеси в руде — соединения марганца, кремния, фосфора:
![]()
Mn, Si, Р растворяются в железе, а неметаллы еще и реагируют с ним с образованием Fe3Si, Fe3P.
Примеси соединений серы окисляются кислородом до сернистого газа, а также превращаются в сульфиды CaS и FeS.
3. Реакции с участием флюсов. Флюсы — природные карбонаты (СаСO3, MgCO3):
![]()
Шлак — CaSiO3, MgSiO3, некоторые сульфиды (CaS, FeS).
Кроме чугуна и шлака, в домне образуется доменный газ — смесь СО, СO2, N2.
Производство стали
Сталь — сплав железа, где w(C) < 2%, а Р и S содержится очень мало.
1. Конверторный процесс. Используют железный лом, руду, известняк, чугун.
Основные химические реакции:
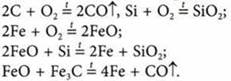
2. В мартеновских печах. Основные компоненты: чугун, обогащенная руда, железный лом, в котором много ржавчины, используют природный газ как топливо, добавляют флюсы — известняк или известь.
![]()
Шлаки содержат до 3% Р.
3. Производство в электропечах. С помощью электрического тока в них создается температура свыше 2000 °С, что позволяет добывать металл с очень малым содержанием S и Р.
Легирующие добавки — Mn, Cr, Ni, W — улучшают свойства стали, придают устойчивость к коррозии.
Коррозия — процесс разрушения металлов вследствие их химического взаимодействия с веществами окружающей среды.
Коррозия металла чаще всего происходит при участии воды и водных растворов элеодэолитов. Ее скорость зависит от активности металла, температуры, кислотноЯр среды, железо ржавеет, т. к. оно контактирует с Н2O на воздухе:
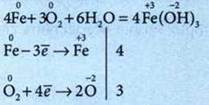
Металлы защищают от коррозии, покрывая красками, лаками, другими металлами, смазывая маслами. Широко используется нержавеющая сталь.
Николай Николаевич Бекетов (1826-1911) — выдающийся русский ученый. Известным его трудом является «Исследование над явлениями вытеснения одних элементов другими» (1865). Установил ряд активности металлов. Открыл свойство алюминия вытеснять при высокой температуре металлы из их оксидов. Это открытие впоследствии было положено в основу металлотермии, которая широко применяется в металлургии. Он впервые с 1865 г. ввел преподавание физической химии как учебной дисциплины.
ПРОВЕРЬТЕ СЕБЯ
1. Атом элемента имеет на три электрона больше, чем ион натрия. Назовите элемент, составьте электронные формулы его атома и иона.
2. Элемент относится ко II группе периодической системы химических элементов Д. И. Менделеева. Масса 3,01 ∙ 1023 молекул его гидроксида равна 29. Назовите элемент, запишите электронную формулу его атома.
3. Элемент входит в I группу периодической системы химических элементов Д. И. Менделеева. Относительная молекулярная масса его гидроксида имеет одинаковое значение с относительной атомной массой элемента с порядковым номером 20. Назовите элемент, запишите электронную формулу его атома.
4. Оксид химического элемента I группы главной подгруппы имеет относительную молекулярную массу 94. Назовите химический элемент, составьте формулу гидроксида.
5. Гидроксид химического элемента I группы главной подгруппы имеет относительную молекулярную массу, равную относительной атомной массе химического элемента II группы главной подгруппы. Назовите химические элементы, составьте электронные формулы атомов этих химических элементов.
6. Атом элемента имеет на 2 электрона больше, чем ион калия. Назовите элемент, составьте электронные формулы его атома и иона.
7. Запишите уравнения реакций, соответствующие таким преобразованиям:
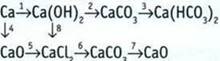
8. Запишите уравнения реакций, соответствующие таким преобразованиям:
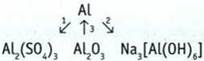
9. Никель получают восстановлением оксида никеля(II) углеродом по реакции NiO + С = Ni + СО. Какую массу угля надо взять для получения никеля массой 354 г, если массовая доля углерода в угле составляет 92% и для реакции необходим двойной избыток углерода?
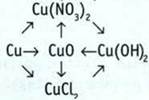
10. Напишите уравнения реакций, с помощью которых можно осуществить следующие преобразования:
11. Методом электронного баланса подберите коэффициенты в схемах реакций взаимодействия металлов с кислотами.
![]()
12. Какой минимальный объем раствора с массовой долей хлорида водорода 20% и плотностью 1,1 r/мл требуется для растворения смеси цинка и никеля массой 49 г, если массовая доля никеля в смеси составляет 60,2%?
13. При восстановлении водородом смеси оксида железа(II) и оксида железа(III) массой 148 г получили железо массой 112 г. Определите массовые доли каждого из оксидов в смеси.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Растворенная железная проволока ярко горит, образуя окалину
А МдО
Б FeO
В Fe2О3
Г Fe3О4
2. Для получения металлов можно воспользоваться следующими способами:
А металлотермия
Б восстановление оксидов водородом
В восстановление оксидов коксом, оксидом углерода(II)
Г кипячение
Д добавление соды и извести
![]()
3. Укажите неметаллы, с которыми не взаимодействуют металлы.
А галогены
Б кислород
В сера
Г инертные газы
Д водород
![]()
4. С водой не взаимодействуют
А натрий
Б калий
В железо
Г медь
Д кальций
![]()
5. Укажите самый распространенный в природе металл.
А натрий
Б медь
В алюминий
Г железо
6. Укажите пару соединений, которые взаимодействуют.
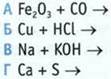
7. Укажите схему реакции, в результате которой можно получить гидроксид железа(II).
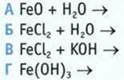
8. С какими из перечисленных веществ реагирует Na?
А Н2O
Б Сl2
В КОН
Г NaCl
Д НСl
![]()
9. Водород вытесняет из раствора соляной кислоты
А медь
Б золото
В ртуть
Г цинк
![]()
10. Железо может взаимодействовать с такими растворами веществ:
А сульфат меди(II)
Б хлорид алюминия
В нитрат калия
Г гидроксид натрия
![]()
11. Увеличение металлических свойств происходит в ряду
А К, Rb, Cs
Б Na, Mg, Al
В Mn, Fe, Co
Г Se, S, O
12. Укажите вещество, которое при взаимодействии с водой образует щелочь.
А фтор
Б оксид цинка
В калий
Г оксид фосфора(V)
13. Железную пластину массой 1 г погрузили в раствор соляной кислоты, при этом масса пластины уменьшилась на 56%. Какой объем газа в мл выделился в результате этой реакции?
А 224 мл
Б 22,4 мл
В 2,24 мл
Г 20,4 мл
14. В каком количестве хлорида натрия содержится столько же натрия, сколько его есть в составе 5 моль ортофосфата натрия?
А 15 моль
Б 1,5 моль
В 10 моль
Г 5 моль
15. При разложении 92 г доломита образовался оксид магния массой 18 г. Определите массовую долю (в %) некарбонатных примесей в этом образце доломита.
А 10%
Б 9%
В 6%
Г 8%