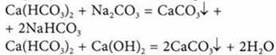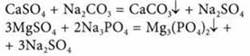Химия - учебно-практический справочник
Щелочные и щелочноземельные элементы - Металлические элементы и их соединения. Металлы - Неорганическая химия
Li, Na, К, Rb, Cs, Fr — щелочные элементы.
Натрий и калий
Природные соединения: NaCl — поваренная соль, галит; Na2SO4 ∙ 10Н2O — глауберова соль, мирабилит; NaCl ∙ КСl — сильвинит; КСl — сильвин, КСl ∙ MgCl2 ∙ 6Н2O — карналлит; Na2O ∙Аl2O3 ∙ 6SiO2 и К2O ∙ Аl2O3 ∙ 6SiO2 — полевые шпаты.
Электронное строение атомов и ионов натрия и калия
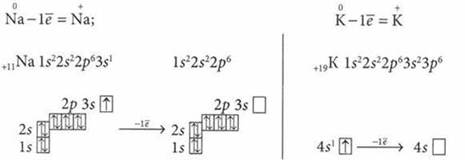
Простые вещества натрия и калия — легкоплавкие, легче воды, мягкие, легко режутся ножом, имеют металлический блеск на свежем срезе.
Химические свойства натрия и калия
1. Взаимодействуют с кислородом: ![]()
2. Взаимодействуют с водородом: ![]()
3. Взаимодействуют с серой: ![]()
4. Взаимодействуют с Н2O: ![]()
5. Взаимодействуют с кислотами: ![]()
Если используют не чистые кислоты, а их водные растворы (концентрированные, разбавленные), то металлы одновременно реагируют с водой.
6. Взаимодействуют с галогенами: ![]()
Оксиды натрия и калия
Na2O, К2O — основные оксиды. Они образуются при нагревании пероксидов с соответствующими металлами при отсутствии воздуха: ![]()
Химические свойства
1. Взаимодействуют с Н2O: Na2O + Н2O = 2NaOH.
2. Взаимодействуют с кислотными оксидами: Na2O + СO2 = Na2CO3.
3. Взаимодействуют с кислотами: Na2O + 2НСl = 2NaCl + Н2O.
Гидроксиды натрия и калия (NaOH, КОН)
NaOH, КОН — едкий натр, едкое кали. Растворяются в Н2O с выделением большого количества теплоты, хорошо поглощают влагу.
NaOH, КОН — сильные основания (щелочи).
|
NaOH, КОН |
+ кислотные, амфотерные оксиды
|
|
+ кислоты и амфотерные гидроксиды
|
|
|
+ соли
|
А также вступают в реакции с некоторыми органическими веществами (карбоновыми кислотами, жирами, аминокислотами, белками):
![]()
Соли калия используют как удобрения:
|
NaCl ∙ KCl — сильвинит KCl — хлорид калия K2SO4 — сульфат калия |
калийные удобрения |
|
К2СO3 — поташ KNO3 — нитрат калия NH4H2PO4, NH4NO3 и KCl (или K2SO4) - нитрофоска |
комплексные удобрения |
Магний и кальций
В главную подгруппу II группы периодической системы входят Be, Mg, Са, Sr, Ва, Ra.
Природные соединения: MgCO3 — магнезит, КСl ∙ MgCl2 ∙ 6Н2O — карналлит, MgCO3 ∙ СаСО3 — доломит, СаС03 — мел, мрамор, известняк; CaSO4 ∙ 2Н2О — гипс; CaF2 — флюорит,Ca5(PO4)3F — фторапатит. В природной воде есть Са2+ и Mg2+.
Электронное строение атомов и ионов кальция и магния
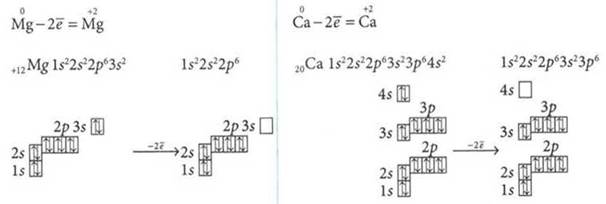
Mg и Са — серебристо-белые легкие металлы, тяжелее щелочных, имеют более высокие tпл. Активность Mg и Са высока, но меньше, чем щелочных металлов.
Химические свойства кальция и магния
1. Взаимодействуют с кислородом:
2Са + O2 = 2СаО оксид кальция.
2. Медленно реагируют с водой:
Са — при нормальных условиях,
![]() a Mg — только при нагревании.
a Mg — только при нагревании.
3. Взаимодействуют с кислотами:
a) с соляной НСl и разбавленной серной образуется водород: ![]()
б) с азотной — продукты восстановления азота:
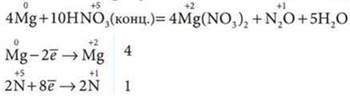
в) с серной — продукты восстановления серы:
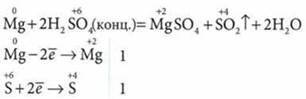
4. Mg взаимодействует с растворами солей, вытесняет менее активные металлы:
Mg + CuSO4 = MgSO4 + Сu, а Са одновременно реагирует с водой.
Оксиды магния и кальция — MgO и СаО— белые тугоплавкие вещества, основные оксиды.
|
Химические свойства СаО |
+ Н2O: СаО + Н2O = Са(ОН)2 |
|
+ кислоты: СаО + H2SO4 = CaSO4 + Н2O |
|
|
+ кислотный оксид: СаО + N2O5 = Ca(NO3)2 |
|
|
+ амфотерный гидроксид: СаО + Zn(OH)2 = CaZnO2 + Н2O |
Гидроксиды магния и кальция — Mg(OH)2 и Са(ОН)2 — белые порошки, малорастворимые в воде.
Суспензия Са(ОН)2 — известковое молоко, а водный раствор Са(ОН)2 — известковая вода.
Са(ОН)2 — гашеная известь, используется в строительстве, хлорная известь Са(СlO)2 — дезинфицирующее средство.
Водная суспензия Mg(OH)2 — лекарственное средство.
2CaSO4 ∙ Н2O — алебастр.
MgSO4 ∙ 7Н2O — глауберова соль (сернокислая магнезия) — лекарственный препарат.
Кислые ортофосфаты кальция применяют как фосфорные удобрения:
Са(Н2РO4)2 ∙ Н2O и CaSO4 ∙ 2Н2O — простой суперфосфат;
Са(Н2РO4)2 ∙ Н2O — двойной суперфосфат;
СаНРO4 ∙ 2Н2O — преципитат;
Са3(РO4)2 — фосфоритная мука.
Ионы Са2+ и Mg2+ определяют (или обусловливают) жесткость воды.
|
Жесткость воды бывает: |
|
|
временная, или карбонатная (Са2+, Mg2+, HCO3-) |
постоянная, или некарбонатная (Са2+, Mg2+, SO42-, Сl-) |
|
Методы устранения |
|
|
1. При кипячении воды 2. Добавление кальцинированной соды Na2CO3 или извести Са(ОН)2
|
1. Применение кальцинированной соды Na2CO3 или ортофосфата натрия Na3PO4
|
В свободном состоянии калий получил английский физик и химик Г. Дэви в 1807 г. электролизом едкого кали. Еще арабские ученые знали щелочи. «Алкали» с арабского — зола, щелочь. Отсюда и название калий, которое было введено в российскую номенклатуру в 1881 г. русским химиком Германом Ивановичем Гессом (1802-1850). Профессор Харьковского университета Ф. И. Гизе еще в 1813 г. использовал слово «калий», называя этот элемент.
Кальций в лабораторных условиях получил Г. Дэви в 1808 г. путем электролиза.
ПРОВЕРЬТЕ СЕБЯ
1. Назовите элемент: находится в I группе, относительная молекулярная масса гидроксида равна 40.
2. Назовите элемент: находится во II группе, массовая доля элемента в гидроксиде равна 54,05%.
3. Напишите уравнение реакции между простыми веществами, образованными элементами, электронные формулы атомов которых имеют следующие значения: ...3s1 и ...2s22p4. Укажите окислитель и восстановитель.
4. Укажите пары порядковых номеров элементов, высшие оксиды которых реагируют между собой. Составьте соответствующие уравнения реакций.
А 11 и 1.
Б 3 и 1.
В 19 и 25.
5. Укажите, какие из предложенных оксидов могут реагировать между собой: Na2O, CaO, SiO2, Al2O3, P2O5, SO3, PbO, NO.
6. Объясните, почему солевой состав природной воды остается практически неизменным, в то время как реки ежегодно вносят в океан около 1,5 млн тонн гидрокарбоната кальция?
7. Запишите уравнения реакций, соответствующие таким преобразованиям:
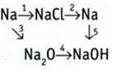
ТЕСТОВЫЕ ЗАДАНИЯ
1. Какие частицы имеют такие же электронные оболочки, как и катион кальция?
А катион калия
Б атом хлора
В анион хлора
Г катион водорода
![]()
2. Жесткость воды обусловливают
А соли натрия
Б соли калия
В растворимые соли кальция и магния
Г соли лития
3. Жесткую воду перед использованием смягчают
А гашеной известью
Б хлоридом натрия
В сульфатом магния
Г содой
4. Укажите калийные удобрения.
А простой суперфосфат
Б преципитат
В сильвинит
Г костная мука
Д поташ
Е хлорид калия и сульфат калия
![]()
5. При взаимодействии щелочного металла с водой получили раствор щелочи массой 250 г с массовой долей щелочи 2,8% и газ объемом 1,4 л (н. у.). Определите название и порядковый номер этого металла в периодической системе Д. И. Менделеева.
А К; 19
Б Na; 11
В Rb; 37
Г Cs; 55
6. Массовая доля карбоната кальция в известняке составляет 90%. Какую массу известняка надо взять для получения гидроксида кальция массой 20 кг?
А 40 кг
Б 30 кг
В 3 кг
Г 3,5 кг
7. Расположите вещества в ряд по данной цепочке: основной оксид основание → средняя соль → кислая соль.
А Мg(НСO3)2
Б МgСO3
В МgО
Г Мg(OН)2
![]()
8. На раствор, содержащий 16 г смеси хлорида натрия и сульфата натрия, подействовали избытком раствора нитрата бария. При этом образовался осадок массой 23,3 г. Найдите массовые доли солей натрия в смеси.
А 85% Na2SO4; 15% NaCl
Б 85,5% Na2SO4; 14,5% NaCl
B 88,75% Na2SO4; 11,25% NaCl
Г 87% Na2SO4; 13% NaCl
9. На сгорание двухвалентного металла массой 0,4 г расходуется кислород массой 0,16 г. Определите этот металл.
А Са
Б Сu
В Zn
Г Мg
10. При взаимодействии одновалентного металла массой 2,8 г с водой образовался гидроксид, масса которого равна 9,6 г. Определите этот металл.
A Li
Б Na
В К
Г Rb
11. На взаимодействие с двухвалентным металлом массой 2,4 г израсходовано 200 г раствора этановой кислоты с массовой долей растворенного вещества 6%. Определите этот металл.
А Мg
Б Са
В Сu
Г Zn
12. Оксид углерода(IV), полученный при сжигании 4,48 л метана (н. у.), пропустили через раствор гидроксида натрия, объем которого 100 мл, плотность 1,32 г/см3, массовая доля растворенного вещества 28%. Какая соль образовалась при этом? Определите ее массу.
А 2 г Na2CO3
Б 2,12 г Na2CO3
В 2,3 г Na2CO3
Г 2,4 г Na2CO3
13. Какая масса известняка, содержащего 5% некарбонатных примесей, необходима для получения негашеной извести массой 112 кг?
А 21 кг
Б 210,53 кг
В 2110 кг
Г 2000 кг
14. Барий получают восстановлением его оксида алюминием. Укажите массовую долю практического выхода бария, если из оксида бария массой 4,59 кг было получено 3,8 кг этого металла.
А 93%
Б 92,46%
В 95%
Г 96%
15. Укажите массу гидроксида-натрия, необходимого для полной нейтрализации 126 г раствора азотной кислоты с массовой долей 10%.
А 12 г
Б 18 г
В 8 г
Г 10 г