Химия - учебно-практический справочник
Электролиз - Металлические элементы и их соединения. Металлы - Неорганическая химия
Электролиз — совокупность процессов, происходящих при прохождении электрического тока через расплав или через раствор электролита.
Электролиз расплава МgСl2
![]()
При прохождении тока через расплав MgCl2 катионы магния под действием электрического поля движутся к отрицательному электроду — катоду (К). Здесь, взаимодействуя с электронами, которые поступают по внешнему кругу, катионы магния восстанавливаются:
![]()
Хлорид-ионы перемещаются к положительному электроду — аноду (А) и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия — окисление хлорид-ионов:
![]()
а вторичным — связывание атомов хлора, которые при этом образуются, в молекулы:
![]()
Складывая уравнения процессов, происходящих возле электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплаваMgCl2:
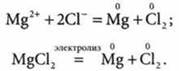
При электролизе химическая реакция происходит за счет энергии электрического тока, который подводят извне.
Электролиз растворов
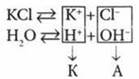
Электролиз водного раствора КСl
Если в растворе присутствуют анионы бескислородных кислот в смеси с ОH-:

Суммарное уравнение электролиза водного раствора КСl:
![]()
или
![]()
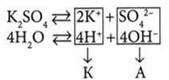
Электролиз водного раствора К2SO4
Если в растворе соли кислородсодержащей кислоты на аноде окисляются ОН-:

Суммарное уравнение:
![]()
или
![]()
Во время электролиза водных растворов солей кислородсодержащих кислот подвергается электролизу только вода.
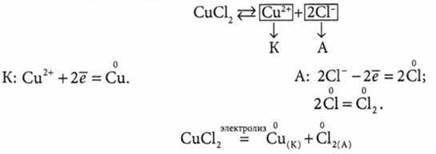
Электролиз водного раствора СuСl2
![]()
Медь в ряду активности металлов размещена после водорода, поэтому возле катода будет происходить разрядка ионов Сu2+ и выделение металлической меди. Возле анода будут разряжаться хлорид-ионы.
Схема электролиза раствора хлорида меди(II):
Электролиз применяется в металлургической и химической промышленности, в гальванотехнике.
В металлургической промышленности электролизом расплавленных веществ и водных растворов добывают металлы, а также проводят электролитическое рафинирование — очистку металлов от вредных примесей и извлечение ценных компонентов. Электролитическим способом рафинируют медь, никель, свинец, олово, серебро, золото.
К гальванотехнике относятся:
1) гальваностегия — нанесение с помощью электролиза на поверхность металлических изделий слоев других металлов для защиты этих изделий от коррозии, увеличения прочности их поверхности, а также в декоративных целях;
2) гальванопластика — процессы изготовления точных металлических копий рельефных предметов электроосаждением металла.
ПРОВЕРЬТЕ СЕБЯ
1. Составьте молекулярные уравнения реакций, с помощью которых можно осуществить преобразования по схеме: ![]()
2. Составьте молекулярные уравнения реакций, с помощью которых можно осуществить преобразования по схеме: ![]()
3. При обычных условиях железо реагирует с
А фосфором
Б концентрированным горячим раствором гидроксида калия
В концентрированной соляной кислотой
Г водой
4. При взаимодействии железа с концентрированной азотной кислотой образуется:
А N.
Б NO2
В NH4NO3
Запишите уравнение химической реакции.
5. Чистое железо можно получить восстановлением из его оксидов водородом, алюминием и оксидом углерода(II). Приведите примеры.
Выполните систему преобразований.
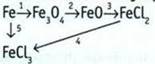
7. Выведите формулу оксида железа, в котором массовая доля металла составляет 70%. В ответе укажите сумму индексов в найденном соединении.
8. Напишите уравнение реакции электролиза расплава бромида калия.
9. Напишите уравнения реакций электролиза водного раствора серной кислоты с инертными электродами.
10. Какая масса натрия выделится на катоде при электролизе расплава иодида натрия, если на аноде выделился иод массой 762 г?
11. При электролизе расплава хлорида калия на катоде получили калий массой 7,8 г. Определите объем хлора (при н. у.), который выделился на аноде.
12. Во время электролиза водного раствора нитрата серебра с инертными электродами на аноде выделился кислород массой 12 г. Какая масса серебра при этом образовалась?
ТЕСТОВЫЕ ЗАДАНИЯ
1. Для получения хлорида железа(II) к железу добавляем
А соляную кислоту
Б хлорид калия
В хлор
Г хлорид натрия
2. Чтобы получить сульфат железа(III), к оксиду добавляем
А оксид ceры(VI)
Б серную кислоту
В оксид ceры(IV)
Г сульфат натрия
3. Сокращенное ионное уравнения получения хлорида железа(III) из гидроксида имеет вид
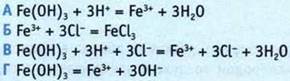
4. К каким элементам относится железо?
A s-элементы
Б р-элементы
В d-элементы
Г f-элементы
5. Какие соединения железа амфотерные?
A FeO
Б Fe2O3
В Fe(OH)2
Г Fe(OH)3
![]()
6. Если к желтовато-коричневому раствору хлорида железа(III) добавить раствор иодида калия, то жидкость приобретает темно-коричневую окраску. Объясните, почему. Какое соединение образовалось? Запишите уравнение химической реакции. В ответе укажите общую сумму коэффициентов.
![]()
7. Важнейшая соль железа — железный купорос. Укажите его формулу.
A FeCl3 ∙ 6Н2O
Б Fe2(SO4)3 ∙ 9Н2O
В FeSO4 ∙ 7Н2O
Г Fe(NO3)3 ∙ 9Н2O
8. Какую массу нитрата железа(III) нужно взять для получения оксида железа(III) массой 8 г?
А 2,42 г
Б 24,2 г
В 242 г
Г 0,242 г
9. Определите формулу вещества X: ![]()
A Fe(NO3)3
Б FeCl3
В Fe2(SO4)3
Г Fe2O3
10. Укажите ряд веществ, с которыми реагирует железо.
A F2, BiCl3, Н2O
Б NaCl, КОН, Аg
В Mg(NO3)2, Аl(OН)3, Аu
Г Нg, K2SO4, К2O
11. При термическом разложении какого соединения можно получить оксид железа(III)?
A FeCO3
Б Fe(NO3)3
В FeSO4
Г Fe(NO3)2
12. Какое соединение очень трудно получить реакцией обмена в водном растворе: оно быстро окисляется кислородом воздуха и превращается в гидроксид железа(III)?
A FeCl2
Б Fe(OH)2
В FeCO3
Г FeSO4
13. Взаимодействие оксида железа(III) со щелочами, а также с карбонатами щелочных и щелочноземельных элементов происходит только при сплаве или спекании соединений. Продуктами реакции являются соли
А нитраты
Б ферриты
В ферраты
Г фосфаты
14. В карбиде железа массовая доля углерода составляет 6,67%. Определите формулу карбида железа. Сколько атомов железа входит в состав соединения?
А 3
Б 2
В 1
Г 4
15. На восстановление оксида железа массой 11,6 г до металла потратили водород объемом 4,48 л (н. у.). Определите формулу соединения, назовите его. Сколько атомов железа входит в состав соединения?
A Fe
Б FeO ∙ Fe2O3 = Fe3O4
В Fe2O3
Г другой вариант