Химия - учебно-практический справочник
Галогены - Неметаллические элементы и их соединения. Неметаллы - Неорганическая химия
Главную подгруппу VII группы периодической системы образуют р-элементы — галогены фтор, хлор, бром, иод, астат. Кроме астата, все они встречаются в природе.
Окислительная способность уменьшается в ряду галогенов от фтора к иоду: F > Cl > Br > I, а восстановительные свойства увеличиваются.
Химические формулы
F2 — фтор, ![]() неполярная ковалентная связь.
неполярная ковалентная связь.
Сl2 — хлор; Вг2 — бром, I2 — иод.
F2, Сl2 — газы, Вr2 — жидкость, I2 — кристаллы.
Реакции, характерные для хлора
1. Взаимодействует с металлами, образуются хлориды:
![]()
2. Взаимодействует с неметаллами:
![]()
3. Взаимодействует с водой, образуются две кислоты:
![]()
хлор одновременно является и окислителем, и восстановителем.
Хлорид водорода (НСl), или хлороводород, является одним из важнейших неорганических соединений. Он служит реагентом в различных процессах в химической технологии. Водный раствор хлороводорода — соляную, хлороводородную, хлоридную кислоту — широко используют в промышленности, химических лабораториях.
Электронная формула молекулы хлороводорода: ![]() графическая формула: Н—Сl, связь ковалентная полярная:
графическая формула: Н—Сl, связь ковалентная полярная: ![]()
НСl — хлороводород — бесцветный газ с резким запахом, тяжелее воздуха, хорошо растворяется в воде, сильно раздражает дыхательные пути.
Хлоридная кислота — НСl — сильная кислота. α(НСl) превышает 90%. Тривиальное название — соляная кислота.
Химические свойства соляной кислоты
1. Взаимодействует с металлами (металлы, размещенные в ряду активности справа от водорода, с НСl не взаимодействуют):
![]()
2. Взаимодействует с основными и амфотерными оксидами:
![]()
3. Взаимодействует с основаниями и амфотерными гидроксидами:
![]()
4. Взаимодействует с большинством солей:
![]()
Получение хлороводорода и соляной кислоты
В промышленных условиях:
1. Горение водорода в атмосфере хлора: ![]()
В лаборатории: ![]()
хлороводород растворяют в воде и получают соляную кислоту.
Качественная реакция для определения ионов Сl-:
![]()
Применение хлороводорода, соляной кислоты и хлоридов

ПРОВЕРЬТЕ СЕБЯ
1. Назовите элемент: находится в к VII группе, относительная молекулярная масса соединения с водородом равна 81.
2. Элемент входит в VII группу периодической системы химических элементов Д. И. Менделеева. Масса 1 л водородного соединения элемента при нормальных условиях равна 1,63 г. Назовите элемент, запишите электронную формулу его атома.
3. Атом элемента имеет на 7 электронов больше, чем ион натрия. Назовите элемент, составьте электронные формулы его атома и иона.
4. ![]() Запишите уравнения реакций.
Запишите уравнения реакций.
5. Запишите уравнения реакций, если они происходят.
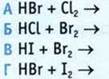
6. Запишите возможные уравнения реакций. В приведенных уравнениях реакций укажите способ получения хлороводорода в лабораторных условиях.
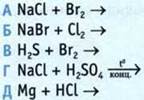
7. В 1 л воды при нормальных условиях растворили 2 л хлороводорода. Вычислите объемную долю этого соединения в образовавшемся растворе.
8. Смесь кислорода и хлороводорода объемом 5 мл (н. у.) пропустили через раствор нитрата серебра, взятого в избытке, и получили осадок массой 14,35 г. Вычислите объемную долю кислорода (%) в смеси.
9. Для осуществления реакции взяли 4,6 г натрия и 10 г хлора. Какое количество вещества хлорида натрия образовалось?
10. Напишите уравнения реакций, с помощью которых можно осуществить такие преобразования: ![]()
11. Напишите уравнения реакций, которые нужно провести для осуществления таких преобразований:
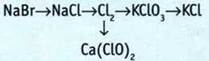
12. В раствор хлорида калия погрузили электроды и пропустили электрический ток. Образовался раствор массой 200 г с массовой долей КОН 2,8%. Какое количество вещества молекулярного хлора выделилось при электролизе?
13. Весь хлороводород, полученный действием избытка серной кислоты на хлорид калия массой 14,9 г, был поглощен водой массой 200 г. Определите массовую долю хлороводорода в растворе, если его выход в реакции составляет 70%.
14. В каких степенях окисления атом иода будет иметь такую же электронную формулу, как и атомы благородных газов криптона и ксенона?
15. Подберите коэффициенты в схемах окислительно-восстановительных реакций методом электронного баланса.
![]()
ТЕСТОВЫЕ ЗАДАНИЯ
1. Галогены непосредственно не реагируют с
А кислородом
Б металлами
В азотом
Г серой
2. Хлорид-ионы определяют в растворе с помощью
А ВаСl2
Б Pb(NO3)2
В AgNO3
Г NaNO3
3. Каким набором реактивов можно определить качественный состав соляной кислоты?
А Сu и Agl
Б Zn и AgNO3
В Mg и K2SO4
Г Нg и NaF
4. Каким реактивом можно распознать растворы хлорида алюминия, хлорида железа(II), хлорида магния, хлорида калия?
А НСl
Б NaOH
В H2SO4
Г AgNO3
5. Определите формулу вещества X: ![]()
A KCl
Б KF
В КВr
Г К2O
6. Сколько образовалось моль водорода при взаимодействии цинка массой 6,5 г с соляной кислотой?
А 1 моль
Б 0,1 моль
В 0,5 моль
Г 5 моль
7. Как добывают хлороводород в промышленности?
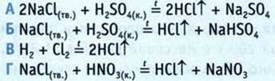
8. Какой хлорид используют в смеси с песком для растапливания льда на дорогах?
А хлорид калия
Б хлорид кальция
В хлорид натрия
Г хлорид меди(II)
9. Соляная кислота относится к
А слабым кислотам
Б сильным кислотам
В кислотам средней силы
10. Соляная кислота реагирует с
А Сu, NaCl, СО
Б СuО, Сu(OН)2, AgNO3
В Na2SO4, Аu, СO2
Г SO2, KNO3, Hg
11. Укажите соединение, которое используется как компонент охлаждающих смесей.
А хлорид калия
Б хлорид натрия
В хлорид кальция
Г хлорид меди(II)
12. Укажите связь между атомами водорода и хлора в хлороводороде.
А ионная
Б ковалентная
В ковалентная полярная
Г ковалентная неполярная
13. Водный раствор хлороводорода называют
А хлорной кислотой
Б соляной кислотой
В серной кислотой
Г азотной кислотой
14. Какой объем газа (н. у.) выделится при взаимодействии достаточного количества соляной кислоты с карбонатом кальция массой 19 г?
А 22,4 л
Б 2,24 л
В 0,224 л
Г 224 л
15. Какой объем хлора вступил в реакцию с водородом, если образовалось 4 л хлороводорода?
А 4 л
Б 2 л
В 3 л
Г 1 л