Химия - учебно-практический справочник
Строение атома - Общая химия
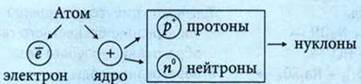
Протонное число — количество протонов в атоме.
Нуклонное число — суммарное количество протонов и нейтронов в атоме.
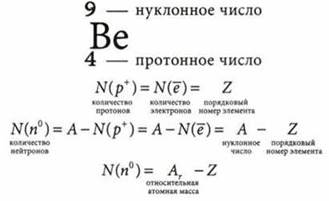
Простые ионы элементов содержат столько же р+ и n0, сколько и атомы, но отличаются от них количеством электронов. В F- находится на 1![]() больше, чем в атоме F, а в Ве2+ — на 2
больше, чем в атоме F, а в Ве2+ — на 2![]() меньше, чем в атоме Be.
меньше, чем в атоме Be.
Виды атомов одного элемента с разным количеством нейтронов называют изотопами, а любой вид атомов — нуклидом.
Изотопы — это нуклиды одного элемента.
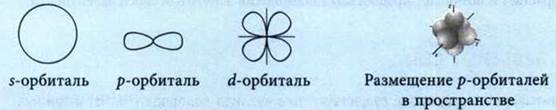
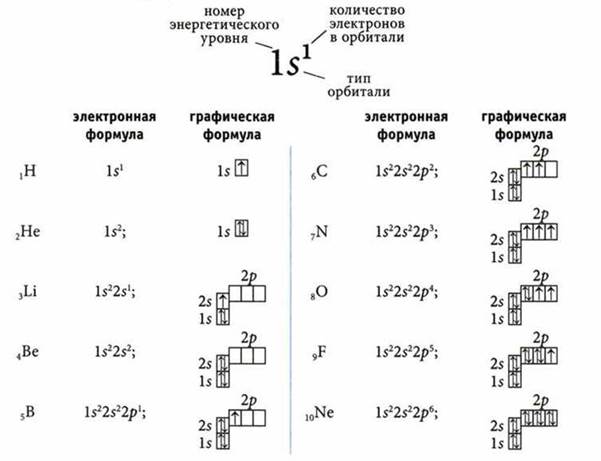
Часть пространства в атоме, где пребывание электрона наиболее вероятно, называют орбиталью.
Упрощенное изображение орбитали □ а ![]() в ней обозначают стрелкой: ↑. Если Ш, то
в ней обозначают стрелкой: ↑. Если Ш, то ![]() называют неспаренным, а если
называют неспаренным, а если ![]() — спаренным, и эти два электрона различаются по признаку, который называют спином.
— спаренным, и эти два электрона различаются по признаку, который называют спином.
По энергии электроны распределяются на энергетических уровнях, которые состоят из подуровней, причем номер уровня указывает на количество подуровней.
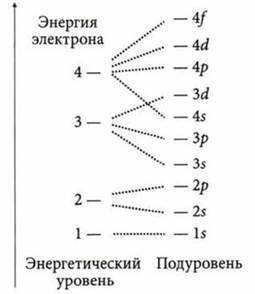
Максимальное количество электронов на энергетическом уровне: ![]() n — номер уровня.
n — номер уровня.
Количество орбиталей на энергетическом уровне: Nop6 = n2.
Типы орбиталей
Заполнения электронами энергетических уровней и подуровней в атомах различных элементов
Процесс перехода электрона с одной орбитали на другую в пределах одного энергетического уровня называют возбуждением атома (* — обозначение возбужденного состояния атома).
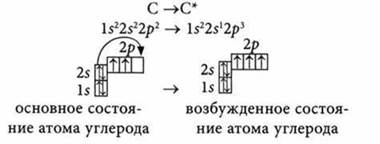
На каждом энергетическом уровне электроны сначала заполняют s-орбитали, а затем — р-орбитали. Число неспаренных электронов в атоме указывает на возможное значение валентности элемента. Атом при наличии свободных орбиталей на последнем энергетическом уровне может переходить в возбужденное состояние. При этом за счет разъединения электронных пар число неспаренных электронов в атоме возрастает и возникает предпосылка повышения элементом своей валентности.
ПРОВЕРЬТЕ СЕБЯ
1. Учитывая, что в природе существуют два нуклида водорода (1Н, 2Н) и три нуклида кислорода (16O, 17O, 18O), определите, сколько может быть разновидностей молекул воды. Напишите их химические формулы с обозначением нуклидов (например 1Н2Н16O). Сколько значений массы может иметь молекула воды?
2. Сколько электронов в ионах S2-, Н+, Н-, Мg2+?
3. Укажите среди перечисленных элемент, атом которого имеет наименьшее количество протонов: С, Мg, К, Аr.
4. Какое значение валентности проявляет атом с приведенной электронной формулой?
![]()
5. Природный магний состоит из изотопов 24Мg, 25Мg, 26Мg. Атомная доля первого нуклида составляет 78,7%, а второго — 10,1%. Определите относительную атомную массу элемента.
6. В медицине используют радионуклид, атом которого содержит 54 заряженные и 33 электронейтральные частицы. Как обозначается этот радионуклид?
7. Назовите типы элементов, которым принадлежат указанные электронные формулы атомов.
A 1s22s22p63s1
Б 1s22s22p2
В 1s22s22p63s23p4
8. На основе строения электронных оболочек атомов объясните постепенное изменение свойств в ряду Na — Mg — Аl и скачкообразное изменение свойств в ряду F — Ne — Na.
9. Атом какого элемента в каждой паре имеет больший радиус: S — Cl, F — Cl, Н — Не, Na — Al? Ответ обоснуйте.
10. Медь имеет два изотопа: 63Сu и 65Сu. Их молярные доли в природной меди составляют 73% и 27% соответственно. Определите среднюю относительную атомную массу меди.
11. Природный хлор содержит два изотопа: 35С1 и 37С1. Относительная атомная масса хлора составляет 35,45. Определите молярную долю каждого изотопа хлора.
12. Назовите два элемента, в атомах которых количество всех s- и р-электронов одинаково (в основном состоянии).
13. Какие оксид, основание, кислота имеют наибольшие массовые доли кислорода среди соединений своего класса? Вычислите их значения.
14. В атоме какого элемента содержится на 2 электрона меньше, чем в ионе магния?
15. Электронная формула атома имеет окончания nd5ms2. Калиевая соль кислоты, которая соответствует высшему оксиду элемента, имеет относительную молекулярную массу 158. Назовите элемент.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите химический элемент, заряд атома которого равен +15.
А B.
Б S.
В К
Г Р
Д N
2. Укажите химический элемент, ядро которого содержит на три протона меньше чем ядро натрия.
A Li
Б Мg
В О
Г Cl
3. Укажите название нуклида, в ядре которого одинаковое число протонов и нейтронов.
А кислород-16
Б натрий-24
В кислород-18
Г хром-52
4. Укажите элемент, ядро которого содержит на три протона больше, чем атом натрия.
А Аl
Б О
В Сl
Г Si
5. Укажите число электронов, находящихся на р-подуровне.
А 2
Б 8
В 6
Г 14
6. Укажите электронную конфигурацию атома фтора.
А 1s22s2p1
Б 1s22s22p63s23p2
В 1s22s22p63s23p5
Г 1s22s22p5
7. Укажите ионы, которые имеют электронную конфигурацию 1s22s22p63s23p6.
A F- и Вr-
Б К+ и Cl-
В Na+ и О2-
Г Мg2+ и S2-
8. Укажите элемент, имеющий электронную конфигурацию 1s22s22p2.
А О
Б К
В N
Г С
9. Укажите электронную формулу иона К+.
А [Аr] 4s1
Б [Ne] 3s23p6
В [Ne] 3s1
Г [Ar] 4s2
10. Укажите атомы элементов с протонными числами, имеющими одинаковое количество энергетических уровней.
А 6 и 22
Б 23 и 73
В 3 и 8
Г 4 и 38
11. По электронному строению атома фосфора отметьте минимальную и максимальную степени окисления этого элемента в соединениях.
А -2 и +6
Б -3 и +5
В -4 и +4
Г -1 и +7
12. Укажите элемент со строением внешнего энергетического уровня ...4s24p5.
A Cl
Б Se
Г Тс
В Вr
13. Укажите элементы с зарядами атомных ядер, имеющими одинаковое количество электронов на внешнем энергетическом уровне.
А+7 и +15
Б +14 и +15
В+13 и +18
Г +3 и +10
14. Укажите форму орбиталей валентных электронов атома калия.
А гантель
Б сфера
В кольцо
Г иная
15. В периодической системе в главной подгруппе щелочные металлы находятся в группе
А V
Б VII
B I
Г II