Химия - учебно-практический справочник
Решение задач по уравнениям реакций - Вычисления в химии
Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакций
Алгоритм решения расчетных задач
1. Составить уравнение химической реакции.
2. Над формулами веществ записать значения известных и неизвестных веществ с соответствующими единицами величин (только для чистых веществ).
3. Под формулами известных и неизвестных веществ записать соответствующие значения величин, найденные по уравнению реакции.
4. Составить пропорцию и решить ее.
5. Записать ответ.
Задача
Вычислите массу серной кислоты, которая потребуется, чтобы нейтрализовать раствор, содержащий гидроксид натрия массой 10 г.

Задача
К раствору, содержащему избыток хлорида железа(Ш), добавили раствор, содержащий 240 г гидроксида натрия. Определите массу и количество образовавшегося гидроксида железа(III).
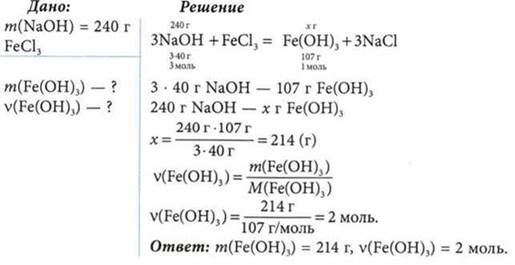
Задача
Сколько образуется кубических метров оксида углерода(IV) при сжигании (н. у.): а) 5 м3 этана б) 5 кг этана?
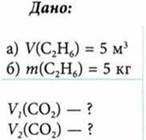
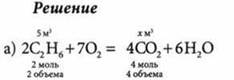
При неизменном давлении объемы реагирующих и образующихся газов, которые относятся между собой как небольшие целые числа, а коэффициенты в уравнении реакции показывают число объемов реагирующих и образующихся газов. Найдем объем образовавшегося СO2:

Решение задач, если вещества взяты в избытке
Задача

Задача

Вычисления по уравнениям химических реакций, если один из реагентов содержит примеси
Задача
Вычислите объем углекислого газа (при н. у.), который выделится при взаимодействии 1 кг известняка, содержащего 10% примесей, с избытком соляной кислоты.

Задача
Рассчитайте массовую долю (в %) углерода в угле, если при сжигании 1 кг угля выделилось 1,12 м3 углекислого газа (при н. у.). Предположите, что примеси в угле горючие.

Вычисления по уравнениям реакций с учетом практического выхода продукта
η — практический выход
![]()
mтеор. или Vтеор. — теоретически возможную массу (объем) продукта рассчитывают по уравнению химической реакции.
mпракт. или Vпракт. — практически возможную массу (объем) продукта измеряют экспериментально после реакции.
Задача
При взаимодействии 2,24 л оксида азота(II) с кислородом образовалось 2 л оксида азота(IV). Определите выход продукта реакции (в %) от теоретически возможного.

Задача
Для производства 142,3 кг аммиачной селитры использовали аммиак объемом 50 м3 (н. у.) и 160 л раствора азотной кислоты с массовой долей 65% (плотность 1391 кг/м3). Определите выход продукта реакции (в %) от теоретически возможного.

Определение вещества, по которому необходимо вести расчеты (по наименьшему):
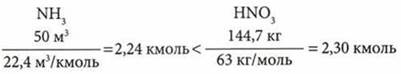
Расчеты проводим по NH3:

Задача
При электролизе расплава хлорида кальция на аноде выделился хлор объемом 198 л (н. у.), а на катоде — кальций массой 240 г. Предполагая, что практический выход кальция составляет 100%, вычислите практический выход хлора.

Решение задач на нахождение молекулярной формулы вещества по количественным данным о реагентах и продуктах реакции
Задача
Определите истинную формулу углеводорода, массовая доля углерода в котором составляет 0,857. Относительная плотность его паров по воздуху равна 1,45.
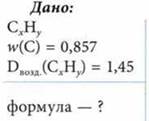
Решение
Данные для определения формулы вещества СхНу:
|
Элемент |
С |
н |
|
W |
0,847 |
0,143 |
|
М, г/моль |
12 |
1 |
Определение нижних индексов:
![]()
Формула простейшая — СН2.
Расчет молярной массы по относительной плотности:
M(СхНу) = 1,45 ∙ 29 г/моль = 42 г/моль.
По эмпирической формуле: М(СН2) = 14 г/моль.
Отношение молярных масс СхНу, и СН2:
![]()
Истинная формула: 3 ∙ СН2 = С3Н6.
Ответ: С3Н6.
Задача
Определите истинную формулу вещества, содержащего по массе 82,8% углерода и 17,2% водорода. Плотность вещества при н. у. равна 2,59 г/л.
Дано:
СХНУ
w(C) = 82,8%
w(H) = 17,2%
ρ(СхНу) = 2,59 г/л
СхНу - ?
Решение
Данные для определения формулы вещества СхНу:
|
Елемент |
С |
Н |
|
W |
0,828 |
0,172 |
|
М, г/моль |
12 |
1 |
Определение нижних индексов:
![]()
Эмпирическая формула — С2Н5.
Расчет молярной массы по относительной плотности:
M(СхНу) = ρ ∙ Vm = 2,59 г/л ∙ 22,4 л/моль = 58 г/моль.
По эмпирической формуле: М(С2Н5) = 29 г/моль.
Отношение молярных масс СxНу и С2Н5:
![]()
Истинная формула: 2 ∙ С2Н5 = С4Н10.
Ответ: С4Н10.
Задача
При сгорании 2,3 г органического вещества в избытке кислорода образовалось 4,4 г оксида углерода(IV) и 2,7 г воды. Относительная плотность паров этого вещества по водороду равна 23. Из каких элементов состоит вещество? Определите его формулу.
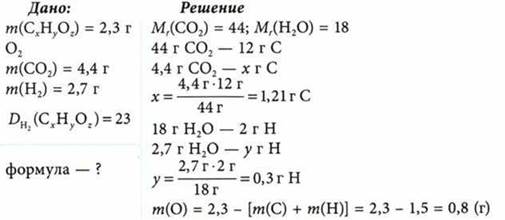
Определение индексов:
![]()
Эмпирическая формула: С2Н6O.
M(CxHyOz) = 23 ∙ 2 г/моль = 46 г/моль; по эмпирической формуле: М(С2Н6O) = 46 г/моль.
Истинная и эмпирическая формулы вещества одинаковые: C2H6O.
Ответ: C2H6O.
Задача
При сжигании 5,6 л газообразного углеводорода образовалось 33 г СO2 и 13,5 г воды. Масса 1 л газа — 1,875 г. Определите формулу вещества.

Решение комбинированных задач
Задача
Колонна синтеза аммиака дает 1500 т продукта в сутки. Рассчитайте массу раствора с массовой долей азотной кислоты равной 63%, который получают из этого количества аммиака.
Если в задаче есть цепь последовательных химических преобразований веществ, то вычисления по каждой реакции не выполняют. Следует составить уравнение всех реакций и по соотношению соответствующих коэффициентов в уравнениях — стехиометрическую схему.
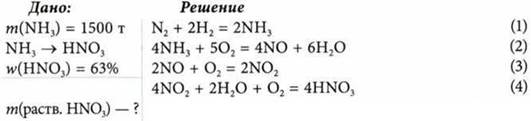
Количество вещества азота должно перейти неизменно в следующие уравнения как исходное вещество. В связи с этим уравнения (1) и (3) следует умножить на 2. Тогда стехиометрическая схема имеет вид:

Задача
После нагревания смеси нитрата цинка и нитрата натрия массой 20,5 г образовавшиеся газы были пропущены через воду, причем 1,12 л газа (н. у.) не поглотилось. Определите состав смеси нитратов.

Поглотилось водой (4NO2 + O2) газов, поэтому осталось 1,12 л O2.
Расчет массы нитрата цинка:
20,5 г - 8,5 г = 12,0 г Zn(NO3)2.
Расчет массовых долей компонентов смеси:
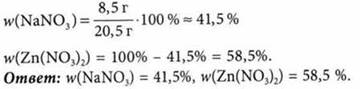
ПРОВЕРЬТЕ СЕБЯ
1. Какие газы при выпускании их в воздух поднимаются вверх, а какие — опускаются вниз: бурый газ N02; сернистый газ — SO2; метан; водород; хлор?
2. Объемные доли водорода и кислорода в смеси составляют соответственно 23 и 77%. Определите среднюю плотность этой смеси по водороду.
3. Молярная масса кристаллогидрата состава CuSO4 ∙ nН2O равна 250 г/моль. Сколько молекул воды входит в состав кристаллогидрата?
4. Углеводород имеет формулу СnНn. Определите п, если известно, что 1,5 моль углеводорода имеют массу 117 г.
5. Образец вещества массой 5,6 г содержит 6,02 ∙ 1022 молекул. Определите молярную массу вещества.
6. Какое количество вещества водорода может быть получено при разложении 112 м3 метана (н. у.)? Вычислите объем водорода (н. у.), который выделится при этом.
7. Определите число молекул углекислого газа в 1 л воздуха, если его объемная доля составляет 0,03% при нормальных условиях.
8. Рассчитайте, какой объем при н. у. занимает смесь, состоящая из 1,44 моль кислорода, 1,83 моль азота, 1,13 моль оксида углерода(IV) и 0,60 моль оксида серы(IV).
9. Определите формулу вещества, содержащего по данным химического анализа 43,4% натрия, 11,3% углерода и 45,3% кислорода.
10. Определите формулу минерала криолит (xNaF ∙ yAlF3), в котором массовые доли NaF и AlF3 равны соответственно 60 и 40%.
11. Найдите молекулярную формулу газообразного углеводорода, если известно, что он в два раза тяжелее воздуха, а содержание в нем углерода — 81,8%.
12. При сжигании 4,4 г вещества образовалось 13,2 г углекислого газа и 7,2 г воды. Относительная плотность вещества по водороду равна 22. Определите формулу вещества.
13. При сжигании 10 г углеводорода образовалось 27,5 г углекислого газа и 22,5 г воды. Относительная плотность вещества по кислороду равна 0,5. Определите формулу вещества.
14. При сжигании 8,8 г насыщенного углеводорода образовалось 26 г углекислого газа. Плотность вещества составляет 1,96 г/л. Определите формулу вещества.
15. При сжигании углеводорода, количество вещества которого равно 0,1 моль, образовались оксид углерода(IV) объемом 6,72 л и вода массой 7,2 г. Определите формулу углеводорода.