Химия - учебно-практический справочник
ОБЩАЯ ХИМИЯ - Ответы
1. ОБЩАЯ ХИМИЯ
1.1. Основные химические понятия. Вещество
Практика
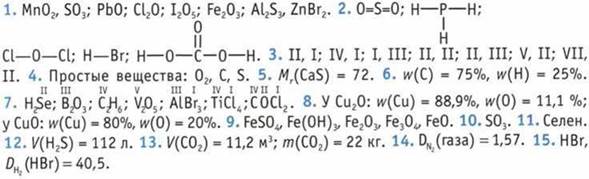
Тест
1. В. 2. А, Б, Д. 3. Б. 4. В. 5. Г. 6. 1-B; 2-Б; 3-А; 4-Г. 7. 1-Б; 2-Б; 3-Б; 4-А; 5-А. 8. 1-Б; 2-А; 3-Б; 4-А. 9. 1-Б; 2-А; 3-Г; 4-В. 10. 1-А; 2-В; 3-Б; 4-Б. 11. Г. 12. Б. 13. Б. 14. Б. 15. В.
1.2. Химическая реакция
Практика
1. ![]() реакция замещения, окислительно-восстановительная, необратимая;
реакция замещения, окислительно-восстановительная, необратимая;
б) ![]() реакция соединения, окислительно-восстановительная, необратимая;
реакция соединения, окислительно-восстановительная, необратимая;
в) ![]() реакция обмена, не окислительно-восстановительная, необратимая;
реакция обмена, не окислительно-восстановительная, необратимая;
г) ![]() реакция разложения, окислительно-восстановительная, обратимая;
реакция разложения, окислительно-восстановительная, обратимая;
д) ![]() реакция разложения, не окислительно-восстановительная, необратимая;
реакция разложения, не окислительно-восстановительная, необратимая;
е) ![]() реакция замещения, окислительно-восстановительная, необратимая.
реакция замещения, окислительно-восстановительная, необратимая.


5. a) 2Ag + S = Ag2S, соединения; 6) 2Аl + 3CuCl2 = 2АlСl3 + 3Сu, замещения; в) Cu(OH)2 = CuO + Н2O, разложения. 6. а) СаСO3 = СаО + СO2; б) С + O2 = СO2. 7. а) 2Нg + O2 = 2НgО, соединения; б) 2НgО = 2Нg + O2, разложения. 8. а) переместится в сторону образования продукта реакции SO2Cl2; б) не переместится. 9. Повысить температуру, уменьшить давление. 10. а) переместится в сторону N02; б) переместится в сторону NO и O2. 11. а) переместится в сторону образования веществ А и В; б) переместится в сторону вещества F. 12. ![]() Изменение степеней окисления атомов имеет место в реакциях а) и в), они окислительно-восстановительные. 13. Это реакция внутримолекулярного окисления-восстановления. Здесь восстановитель
Изменение степеней окисления атомов имеет место в реакциях а) и в), они окислительно-восстановительные. 13. Это реакция внутримолекулярного окисления-восстановления. Здесь восстановитель ![]() и окислитель
и окислитель ![]() входят в состав одного и того же вещества
входят в состав одного и того же вещества ![]() 14. а) окислитель; б) восстановитель.
14. а) окислитель; б) восстановитель.
Тест
1. Г. 2. В. 3. Б, В. 4. А, Б, Г. 5. А, В. б. А, Г, Д. 7. 1-Б; 2-В; 3-Г; 4-А. 8. 1-В; 2-А; 3-Б; 4-Г. 9.1-Д; 2-В; 3-Г; 4-А. 10. А. 11. А. 12. Б.

Коэффициенту восстановителя равен 3.
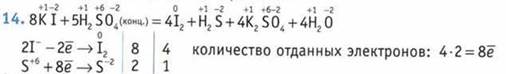
Ответ: 8.
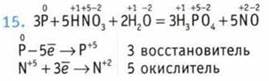
Коэффициент возле окислителя — 5.
1.3. Строение атома
Практика
1. Возможны 9 разновидностей молекул воды и 5 значений массы молекул. 2. ![]()
![]() 3. С. 4. a) Li — I; б) В — III; в) Na — I; г) С — IV. 5. Ar(Мg) = 24,32 ≈ 24. 6.2760Со. 7. а) s-элемент; б) p-элемент; в) р-элемент. 8. Постепенное изменение металлических свойств элементов в ряду Na — Mg — Аl объясняется увеличением количества электронов на внешнем энергетическом уровне (от 1 до 3). Скачкообразное изменение свойств от F до Ne объясняется завершением внешнего энергетического уровня. Скачкообразное изменение свойств отNe до Na объясняется появлением нового энергетического уровня. 9. Радиусы атомов элементов в периоде уменьшаются слева направо, а в группе (подгруппе) растут сверху вниз. S; Cl; Н;Na. 10. 63,5. 11. Χ(35Сl) = 77,5%; Χ(37Сl) = 22,5%. 12. кислород и магний. 13. Н2O, LiOH, Н3ВO3. 14. В атоме кислорода. 15. Марганец.
3. С. 4. a) Li — I; б) В — III; в) Na — I; г) С — IV. 5. Ar(Мg) = 24,32 ≈ 24. 6.2760Со. 7. а) s-элемент; б) p-элемент; в) р-элемент. 8. Постепенное изменение металлических свойств элементов в ряду Na — Mg — Аl объясняется увеличением количества электронов на внешнем энергетическом уровне (от 1 до 3). Скачкообразное изменение свойств от F до Ne объясняется завершением внешнего энергетического уровня. Скачкообразное изменение свойств отNe до Na объясняется появлением нового энергетического уровня. 9. Радиусы атомов элементов в периоде уменьшаются слева направо, а в группе (подгруппе) растут сверху вниз. S; Cl; Н;Na. 10. 63,5. 11. Χ(35Сl) = 77,5%; Χ(37Сl) = 22,5%. 12. кислород и магний. 13. Н2O, LiOH, Н3ВO3. 14. В атоме кислорода. 15. Марганец.
Тест
1. Г. 2. В. 3. А. 4. Г. 5. В. 6. Г. 7. Б. 8. Г, С. 9. Б. 10. В. 11. Б. 12. В. 13. А. 14. Б. 15. В.
1.4. Периодический закон и периодическая система химических элементов Д. И. Менделеева
Практика
1. К. 2. Мg. 3. а) Са, Ва; б) F, Вr; в) Li, Na; г) Ne, Ar. 4. S. 5. Ca. 6 BeO + K2O = K2BeO2, BeO — амфотерный оксид, K2O — основной оксид, ВеО → Ве(0Н)2 → Н2ВеОг. 7. Аl. 8. Общие свойства галогенов: а) в свободном состоянии — неметаллы, имеющие сходные физические свойства (все они окрашены, имеют специфический запах, летучие); б) активно взаимодействуют с водородом и металлами: Н2 + Cl2 = 2HQ + Q; 2Аl + 3Br2 = 2АlВг3 + Q; в) соединения галогенов с водородом — летучие соединения (растворы водородных соединений — кислоты); г) соединения галогенов с металлами — соли; д) почти все соли галогенов хорошо растворимы в воде. 9. Ar(Mg) = 24. 10. К. 11. Н2Те — самая сильная кислота, H2S — самая слабая кислота. 12. 73, германий. 13. 32, сера. 14. Фосфор, P2O5, Н3РO4. 15. Кальций.
Тест
1. Д. 2. Д. 3. Б, Г. 4. Б, Г, Д. 5. Б. б. Б. 7. А. 8. Б. 9. В. 10. В. 11. Б. 12. А. 13. Б. 14. Г. 15. В.
1.5. Химическая связь
Практика
1. ![]() Валентность С — IV. 2. Прочность уменьшается. 3. Е—Р,
Валентность С — IV. 2. Прочность уменьшается. 3. Е—Р, 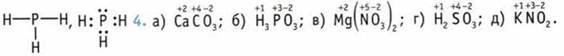 5.
5. ![]() 6. а) +4; б) -3; в) +3. 7. а) +2; б) +6; в) +3. 8. Н → Сl. 9. NaCl, K2S, Na2O. 10. a) +1, -1; б) +1, +6, -2; в) +2, -3. 11. а) сера — калий: 2,6 - 0,91 = 1,69; смещение в сторону атома серы;
6. а) +4; б) -3; в) +3. 7. а) +2; б) +6; в) +3. 8. Н → Сl. 9. NaCl, K2S, Na2O. 10. a) +1, -1; б) +1, +6, -2; в) +2, -3. 11. а) сера — калий: 2,6 - 0,91 = 1,69; смещение в сторону атома серы;
6) сера — водород: 2,6 - 2,1 = 0,5; смещение в сторону атома серы. 12. а) ионная; б) ковалентная неполярная; в) ковалентная полярная. 13. a) Zn2+ и О2-; Сr3+ и О2-; б) К+ и ОН-; Са2+и ОН-; в) К+ и NO3-; Na+ и SiO32-. 14. Cr2O3, K2S. 15. I2, H2O, НCl, NH3.
Тест
1. Б. 2. А. 3. Б. 4. Б. 5. Б, Г. 6. А, Б, Г, Д. 7. А, В. 8. Г. 9. В. 10. В. 11. 1-А; 2-Б; 3-В; 4-А. 12. 1-Б; 2-Г; 3-В; 4-А. 13. Б. 14. Б.15. Г.
1.6. Смеси веществ. Растворы
Практика
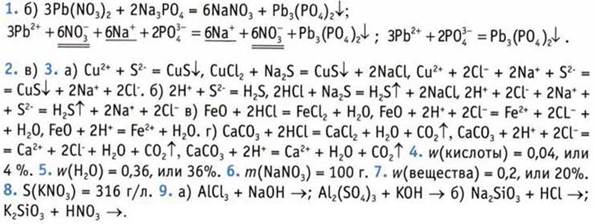
10. 600 г и 200 г 11. Насыщенным. 12. Насыщенный раствор можно превратить в ненасыщенный, если: а) увеличить объем воды настолько, насколько отношение массы растворенного вещества к объему воды будет меньше растворимости взятого вещества при данной температуре; б) нагреть насыщенный раствор до такой температуры, при которой растворимость взятого вещества увеличится, тогда отношение массы растворенного вещества к объему воды будет меньше растворимости данного вещества при данной температуре. 13. 0,0046%. 14. 4,4%. 15.m(К3РO4) = 20 г; m(Н2O) = 230 г.
Тест
1. Б, В, Г. 2. Б, В. 3. Г. 4. Б, В. 5. А, Б, Г. 6. Г. 7. 1Б; 2В; 3А; 4Г. 8. 1Б; 2В; 3А; 4Г. 9. Б. 10. В. 11. А. 12. А. 13. 1Б; 2В; 3Г; 4А. 14. Б.