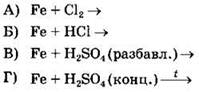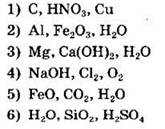Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Задания с комментариями и решениями - Урок 2 - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Задание 1. В перечне веществ

к кислотным оксидам относятся
1) АБВ
2) ВГЕ
3) БГД
4) ВДЕ
К кислотным могут быть отнесены оксиды неметаллов и оксиды d-элементов (металлов) в высшей степени окисления. Таким образом, к кислотным относятся оксид хлора (VII), оксид углерода (IV) и оксид хрома (VI).
Ответ: 2
Задание 2. Кислотным и амфотерным оксидом соответственно являются
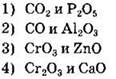
При определении группы оксида важно обращать внимание не только на принадлежность элемента, соединенного с кислородом, к металлам или неметаллам, но и на его степень окисления. В первой паре веществ оба оксида образованы неметаллами в высшей степени окисления, следовательно, они кислотные. Во второй паре первый оксид (СО) — несолеобразующий, а второй (Аl2O3) — амфотерный.
А вот оксиды в третьем варианте ответа соответствуют условию. Первый из них (СrO3) высший оксид хрома, т.е. d-элемента, проявляющий кислотные свойства. А оксид цинка (ZnO) — амфотерный оксид. В четвертом варианте ответа оксид хрома со степенью окисления +3 (Сr2O3) проявляет амфотерные свойства, а СаО — основные.
Ответ: 3
Задание 3. Установите соответствие между классом (группой) неорганических соединений и химическими формулами веществ, к которому они принадлежат.
|
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
ХИМИЧЕСКАЯ ФОРМУЛА |
|
А) средняя соль |
|
|
Б) кислая соль |
|
|
В) кислота |
|
|
Г) основание |
|
А |
Б |
В |
Г |
Для выполнения задания вспомним определения классов (групп) неорганических веществ с точки зрения теории электролитической диссоциации. Состав средних солей (А) предполагает наличие в их составе только катиона металла (или катиона аммония) и аниона кислотного остатка. Среди формул веществ правого столбца присутствует формула NH4Cl (4), отвечающая этим характеристикам. В состав кислых солей (Б) наряду с катионами металлов входят еще и катионы водорода. Такому составу отвечает формула NaHCO3 (5). Характерным признаком кислот (В) является наличие катионов водорода и анионов кислотного остатка. Такому составу отвечает формула сероводородной кислоты H2S (2). Основания (Г) в своем составе содержат только катионы металлов и анионы гидроксогрупп. Формулой вещества такого состава является Mg(OH)2(6).
Ответ: 4526
Задание 4. Как водород, так и хлор при обычных условиях взаимодействуют с
1) водой
2) фторидом натрия
3) гидроксидом кальция
4) натрием
Из условия задания можно сделать вывод, что вещество, которое реагирует и с водородом, и с хлором, с большой вероятностью должно проявлять восстановительные свойства.
Вода реагирует с хлором, но не реагирует с водородом. Фторид натрия — соль, в которой анион (F) не может быть вытеснен хлором. Гидроксид кальция не вступает в реакцию с водородом, но может реагировать с хлором. А вот натрий в реакции и с хлором, и с водородом проявляет восстановительные свойства.
Ответ: 4
Задание 5. В реакцию с железом вступает
1) СаО
2) СO2
3) HCl (p-p)
4) CuSO4 (р-р)
5) NaOH (р-р)
Железо не реагирует с основными и кислотными оксидами. Не реагирует железо и с раствором гидроксида натрия, для которого характерны ярко выраженные щелочные свойства. А вот с соляной кислотой железо реагирует, так как в ряду напряжений (активности) металлов оно расположено левее водорода.
Возможность протекания реакции с сульфатом меди (II) можно также определить с помощью ряда напряжений металлов, в котором железо расположено левее меди, из чего следует, что железо более активный металл и способен вытеснить ионы меди из раствора соли.
Ответ: 34
Задание 6. Верны ли следующие суждения об окислительных свойствах азота?
А. Азот является более слабым окислителем, чем кислород.
Б. Азот является окислителем в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Для оценки верности первого суждения необходимо посмотреть положение химических элементов, образующих простые вещества, в Периодической системе. Кислород во втором периоде расположен правее азота, следовательно, азот является более слабым окислителем, чем кислород. Суждение 1 — верное.
При определении верности второго суждения необходимо определить, какой из элементов, азот или водород, является более электроотрицательным. Им является азот, следовательно, он и будет окислителем. Второе суждение тоже верное.
Ответ: 3
Задание 7. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
|
|
A |
Б |
В |
Г |
В этом задании пригодятся знания о свойствах конкретных окислителей, которые воздействуют на железо. При действии сильных окислителей, таких как Сl2 и H2SO4 (конц.), железо окисляется до степени окисления +3. Если же окислитель более слабый (например разбавленные кислоты), то степень окисления железа изменится только до +2. Учитывая это, подберем для реакций первого столбца соответствующие продукты из второго: А — 6, Б — 4, В — 2, Г — 3.
Ответ: 6423
Задание 8. Верны ли следующие суждения об оксидах меди и их свойствах?
А. Формула высшего оксида меди Сu2O.
Б. Высший оксид меди проявляет только окислительные свойства.
1) верно только А.
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Рассматривая возможность образования медью оксидов, следует обратить внимание на ее положение в Периодической системе. Учитывая то, что медь расположена в I группе, можно предположить, что ее максимальная степень окисления равна +1. Однако это правило не работает для элементов IБ и VIIIB групп. Так, например, медь проявляет две степени окисления +1 и +2, и наиболее устойчивой при этом является степень окисления +2. Именно она и является высшей. Поэтому формула Сu2O не соответствует высшему оксиду меди.
А вот второе утверждение является верным: СuО может быть только окислителем, восстанавливаясь до металлической меди.
Ответ: 2
Задание 9. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
|
НАЗВАНИЕ ОКСИДА A) оксид углерода (IV) Б) оксид меди (II) B) оксид кальция Г) оксид углерода (II) |
ВЕЩЕСТВА
|
|
А |
Б |
В |
Г |
Как видно из названий веществ, все они принадлежат одному классу — классу оксидов, но только относятся к различным группам. Так, например, оксид углерода (IV) (А) — кислотный оксид, со слабовыраженными окислительными свойствами. Поэтому для него возможны реакции с каждым из веществ группы 3, представленной основанием (Са(ОН)2), водой и сильным восстановителем — магнием. Оксид меди (II) (Б) — основный оксид, с окислительными свойствами. Поэтому для него характерны взаимодействия с веществами, проявляющими кислотные и восстановительные свойства: HNO3, С и Сu (ряд 1). Для основного оксида — оксида кальция (В) возможны реакции с каждым веществом ряда 6, образованного водой, кислотным оксидом (SiO2) и кислотой (H2SO4). Оксид углерода (II) (Г) — несолеобразующий оксид, с сильными восстановительными свойствами. Для него характерны реакции с окислителями кислородом и хлором, а также гидроксидом натрия (ряд 4).
Ответ: 3164
Задание 10. Раствор гидроксида натрия реагирует с
1) Ва(ОН)2
2) Ве(ОН)2
3) Mg(OH)2
4) Са(ОН)2
Гидроксид натрия — растворимое основание — щелочь. Следовательно, реагировать с веществами, принадлежащими к классу оснований, оно не будет. А вот с амфотерными гидроксидами — реагирует. К таковым из предложенных соединений относится гидроксид бериллия.
Ответ: 2
Задание 11. Гидроксид хрома (III) взаимодействует с каждым из двух веществ:
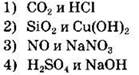
Гидроксид хрома (III) — не растворимый в воде амфотерный гидроксид, который может реагировать с кислотами и щелочами. Анализ предложенных вариантов ответа показывает, что первая пара веществ представлена кислотным оксидом (СO2) и кислотой (НСl), вторая — кислотным оксидом (SiO2) и нерастворимым основанием (Cu(OH)2), в третьей паре веществ — несолеобразующий оксид (NO) и соль (NaNO3), а вот в четвертой — сильная кислота (H2SO4) и щелочь (NaOH). Таким образом, правильный ответ — 4.
Ответ: 4
Задание 12. Реакции концентрированной азотной кислоты с медью соответствует схема превращения
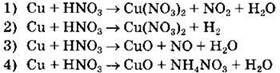
Первое, что необходимо учесть при выполнении задания, что медь — металл, расположенный в ряду активности правее водорода. Второе, надо вспомнить, что азотная кислота, являясь сильным окислителем, обладает особыми свойствами, и в первую очередь это проявляется при взаимодействии с металлами. В результате такого взаимодействия водород не выделяется. Таким образом, ответ 2 — неверный. Обязательными продуктами, которые образуются при взаимодействии азотной кислоты с металлами, являются соли азотной кислоты — нитраты и вода. Исключаем ответы 3 и 4. Состав еще одного продукта реакции зависит от концентрации азотной кислоты и активности металла. Если азотная кислота концентрированная, то преимущественно образуется оксид азота (IV).
Ответ: 1
Задание 13. Соляная кислота реагирует с каждым из двух веществ
![]()
Выполнение данного задания можно осуществить “по вертикали”, т.е. сначала проанализировав первые вещества, а затем — вторые. Серебро и сульфат натрия в реакцию с соляной кислотой не вступают. Серебро — т.к. в ряду активности металлов расположено левее водорода, а сульфат натрия при взаимодействии с соляной кислотой не образует малодиссоциирующих веществ. К этому можно добавить, что и вторые вещества (NO и SO2 — несолеобразующий и кислотный оксиды) в реакцию с НСl не вступают. Варианты ответа 1 и 4 исключаем. В реакцию с амфотерными оксидом (Аl2O3) и гидроксидом (Zn(OH)2) соляная кислота вступает. А вот с нерастворимым BaSO4 реакция не идет, в то время как с основным оксидом FeO реакция возможна.
Ответ: 3
Задание 14. Соль железа(II) можно получить реакциями
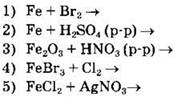
При взаимодействии с разбавленными кислотами железо превращается в соль двухвалентного железа, а при непосредственном взаимодействии с сильными окислителями, например с галогенами, образуются соли железа с зарядом 3+. В двух других взаимодействиях в реакцию уже вступают соединения железа со степенью окисления +3 (Fe2O3и FeBr3). Взаимодействие 3 не относится к окислительно-восстановительным реакциям, а во взаимодействии 4 степени окисления меняют атомы галогенов.
Двухвалентная соль железа образуется и в ходе реакции ионного обмена между хлоридом железа(II) и нитратом серебра. Реакция протекает необратимо за счет образования нерастворимой соли хлорида серебра.
Ответ: 25
Задание 15. В реакцию с раствором хлорида цинка вступает
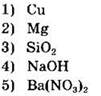
В растворе хлорида цинка находятся хлорид-ионы и ионы цинка. Вытеснить из водного раствора ионы цинка медь не может, т.к. в ряду напряжений стоит правее цинка. А вот магний может, т.к. расположен левее цинка, следовательно активнее него.
Оксид кремния — кислотный оксид, не растворимый в воде, вытеснить хлорид-ион из раствора не может. Гидроксид натрия в ходе реакции ионного обмена образует нерастворимое соединение Zn(OH)2. А вот нитрат бария при взаимодействии с хлоридом цинка малодиссоциирующее вещество не образует. Следовательно, реакция до конца не идет.
Ответ: 23
Задание 16. Продуктами разложения нитрата меди являются:

Ответ: _________ .
(Запишите цифры в порядке возрастания.)
При ответе на этот вопрос вспомним, что все нитраты металлов можно условно разделить на 3 группы по отношению к нагреванию. Нитраты самых активных металлов (щелочных) разлагаются с образованием нитрита и выделением кислорода. Нитраты наименее активных металлов (от Hg до Аu) разлагаются до металла, оксида азота (IV) и кислорода. Все остальные нитраты металлов (от Са до Сu) разлагаются до оксида металла, оксида азота (IV) и кислорода. Следовательно, нитрат меди (металла малоактивного) разлагается по схеме:
![]()
Ответ: 235
Задание 17. В схеме превращений ![]() веществами X1 и Х2 являются
веществами X1 и Х2 являются

Происходят два последовательных превращения, в которых участвуют соединения кальция. При нагревании карбонат кальция разлагается и образуется оксид кальция (Х1 — ответ 3) и углекислый газ. В следующей реакции с азотной кислотой участвует оксид кальция — как представитель класса основных оксидов. При этом образуется соль — нитрат кальция (Ca(NO3)2) и вода. Сопоставляя полученную формулу с вариантами, предложенными в задании, получаем ответ 31.
Ответ: 31
Задание 18. В схеме превращений веществ ![]() конечными продуктами Х2 и Х3 являются
конечными продуктами Х2 и Х3 являются
1) азот
2) аммиак
3) гидрат аммиака
4) оксид азота(II)
5) хлорид аммония
Проследим за превращениями, происходящими в предложенной последовательности реакций. На первом этапе при взаимодействии азота и водорода образуется аммиак (NH3). В результате взаимодействия аммиака и хлороводорода образуется продукт Х2 — NH4Cl (хлорид аммония — 5). А при сплавлении хлорида аммония со щелочью образуется NH3 (аммиак — 2) и NaCl (хлорид натрия).
Ответ: 52
Задание 19. Порошок магния нагрели в атмосфере азота. При взаимодействии полученного вещества с водой выделился газ. Газ пропустили через водный раствор сульфата хрома (III), в результате чего образовался серый осадок. Осадок отделили и обработали при нагревании раствором, содержащим пероксид водорода и гидроксид калия.
Напишите уравнения четырех описанных реакций.
При реакции магния и азота может образоваться только бинарное вещество, в котором у магния ст.ок. +2, а у азота как более электроотрицательного элемента -3.
![]()
При взаимодействии нитрида магния с водой образуются два продукта. К положительно заряженной частице идет отрицательно заряженная частица — группа ОН- с образованием гидроксида магния, а к отрицательно заряженной частице (N-3) присоединяется катион водорода, и образуется аммиак. Подтверждением этого является наличие в условии задания фразы “выделился газ”.
![]()
А в следующей реакции при определении продукта реакции можно исходить из данного в условии комментария к признаку протекания реакции: при добавлении “раствора сульфата хрома (III) образовался “серый осадок”. Единственным веществом, которое может соответствовать этим признакам, является гидроксид хрома (III). Таким образом, мы можем сделать вывод, что аммиак, прореагировав с водой, образовал раствор гидроксида аммония, из которого ион аммония пойдет на взаимодействие с сульфат-ионом, образуя соль:
![]()
На завершающем этапе цепочки превращений образовавшийся осадок обработали пероксидом водорода, который, проявляя окислительные свойства, повышает степень окисления хрома с +3 до +6. Предположим, что продуктом реакции может быть хромат или дихромат калия. Но так как в условии есть указание на участие в реакции гидроксида калия, т.е. щелочной среды, продуктом реакции будет хромат калия.
![]()
Задание 20. Хлорат калия нагрели в присутствии катализатора, при этом выделился бесцветный газ. Сжиганием железа в атмосфере этого газа была получена железная окалина. Ее растворили в избытке соляной кислоты. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту.
Напишите уравнения четырех описанных реакций.
Процесс нагревания хлората калия является одним из известных способов получения кислорода. При этом если кислород повышает степень окисления, то хлор — понижает: с +5 до наиболее устойчивой -1.
![]()
При сжигании кислорода в атмосфере чистого кислорода образуется железная окалина — Fe3O4— смешанный оксид железа в степени окисления +2 (FeO) и +3 (Fe2O3). Составляем уравнение реакции:
![]()
Именно такой состав железной окалины и определяет продукты, образующиеся при ее взаимодействии с соляной кислотой: будут образовываться два хлорида — хлорид железа (II) и хлорид железа (III):
![]()
Воздействие на полученную смесь сильного окислителя — дихромата калия в кислой среде — приводит к повышению степени окисления железа с +2 до устойчивой +3 и понижению степени окисления хрома с +6 до +3. А указание на наличие в растворе соляной кислоты подсказывает нам, что будут образовываться хлориды металлов, участвующих в реакции:
![]()