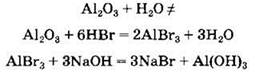Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Химические свойства сложных неорганических веществ - Теоретический материал - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Характерные химические свойства оксидов: основных, амфотерных, кислотных
Химические свойства основных оксидов. Все основные оксиды взаимодействуют с кислотами, образуя соли, например:
![]()
Основные оксиды реагируют с кислотными и с амфотерными оксидами с образованием солей:
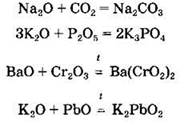
Оксиды щелочных и щелочноземельных металлов, а также таллия(I) взаимодействуют с водой с образованием растворимых в воде оснований — щелочей:
![]()
Некоторые из основных оксидов могут восстанавливаться под действием восстановителей или разлагаться при нагревании:
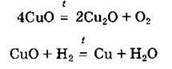
Под действием сильных окислителей некоторые из основных оксидов могут быть окислены до более высоких степеней окисления, например:
![]()
Химические свойства кислотных оксидов. Кислотные оксиды (исключая оксид кремния(IV)) взаимодействуют с водой с образованием соответствующих кислот:
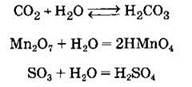
Оксид фосфора(V), взаимодействуя с водой, может образовать как метафосфорную, так и ортофосфорную кислоту:
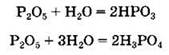
Кислотные оксиды взаимодействуют с основаниями, образуя соли:
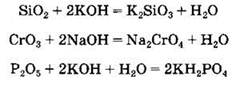
Кислотные оксиды могут взаимодействовать с основными и амфотерными оксидами с образованием солей:
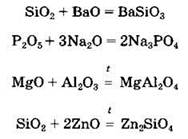
Некоторые из кислотных оксидов могут вступать в окислительно-восстановительные реакции, проявляя как окислительные, так и восстановительные свойства:
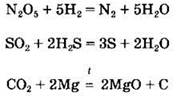
Некоторые из кислотных оксидов могут разлагаться при нагревании:
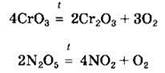
При нагревании некоторые кислотные оксиды вытесняют более летучие из их солей. Так, при производстве стекла протекает реакция:
![]()
Интересной особенностью оксида кремния (IV) является взаимодействие его с плавиковой кислотой:
![]()
Эта реакция лежит в основе “травления” стекла.
Химические свойства амфотерных оксидов. Амфотерные оксиды взаимодействуют как с кислотами, так и со щелочами с образованием солей:
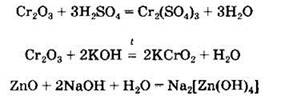
Амфотерные оксиды могут взаимодействовать с кислотными и основными оксидами с образованием солей:
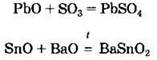
Некоторые из амфотерных оксидов при нагревании реагируют с солями:
![]()
Амфотерные оксиды могут вступать в окислительно-восстановительные реакции, проявляя свойства окислителей или восстановителей:
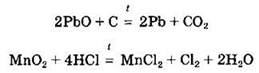
При нагревании некоторые амфотерные оксиды могут разлагаться:
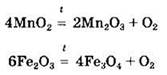
Характерные химические свойства оснований и амфотерных гидроксидов
С точки зрения теории электролитической диссоциации С. Аррениуса основания — сложные вещества, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Основаниями в соответствии с этим определением являются гидроксиды металлов — щелочных, щелочноземельных и некоторых других в невысоких степенях окисления. Растворимые в воде сильные основания называют щелочами. Щелочи изменяют окраску индикаторов: фенолфталеин становится малиновым, лакмус — синим, метилоранж — желтым.
Все основания реагируют с кислотами с образованием солей {реакция нейтрализации):
![]()
Наряду со средними солями в ходе этих реакций могут образовываться кислые или основные соли:
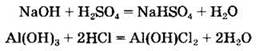
Основания реагируют с кислотными и амфотерными оксидами с образованием солей. В последнем случае в водном растворе образуются комплексные гидроксосоли, а при сплавлении реагентов — оксосоли:
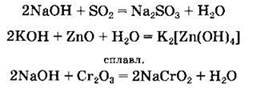
Основания реагируют с амфотерными гидроксидами с образованием солей. При сплавлении образуются оксосоли, в водном растворе — комплексные гидроксосоли:
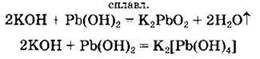
Нерастворимые в воде основания (а также гидроксид лития) разлагаются при нагревании с образованием соответствующего основного оксида и воды:
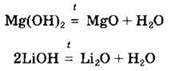
Щелочи могут взаимодействовать с солями. Подобные реакции возможны, если в ходе них образуются осадок, газ или слабый электролит:
![]()
Следует также помнить, что щелочи могут реагировать с некоторыми металлами и неметаллами (окислительно-восстановительные реакции):
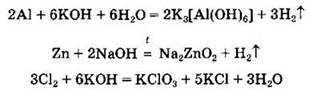
Амфотерные гидроксиды сочетают в себе свойства как оснований, так и кислот. Так, они могут реагировать и с веществами кислотной природы, и с веществами основной природы. Амфотерными являются гидроксиды алюминия, цинка, хрома(III), сурьмы, свинца(II), олова, железа(III) и др. Такие гидроксиды, как Cu(OH)2, Mn(OH)2, Fe(OH)2, проявляют настолько слабые амфотерные свойства, что их относят к основаниям (кислотными свойствами пренебрегают).
Рассмотрим химические свойства амфотерных гидроксидов на примере гидроксида алюминия Аl(ОН)3.
Амфотерные гидроксиды реагируют и с кислотами, и с щелочами:
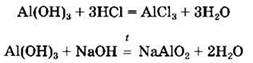
Вторая реакция, сопровождающаяся образованием метаалюмината натрия (оксоалюмината), протекает только при сплавлении реагентов. В водном растворе щелочи образуются различные по составу комплексные соли (гидроксоалюминаты):
![]()
Амфотерные гидроксиды взаимодействуют с кислотными и основными оксидами с образованием солей:
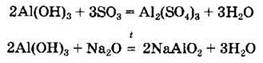
При нагревании амфотерные гидроксиды разлагаются с образованием соответствующих оксидов и воды:
![]()
Характерные химические свойства кислот
Общие свойства кислот. Связаны с наличием в их водных растворах гидратированных ионов водорода, образующихся в процессе электролитической диссоциации:
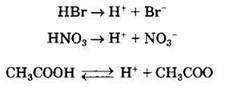
Так, все кислоты изменяют окраску индикаторов: лакмус приобретает красный цвет, метилоранж — розовый.
Все кислоты взаимодействуют с растворимыми и нерастворимыми основаниями (реакция нейтрализации):
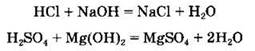
В кратком ионном виде уравнение реакции нейтрализации сильной кислоты с сильным основанием запишется так:
![]()
В ходе этих реакций возможно образование не только средних, но и кислых или основных солей:
![]()
Кислоты взаимодействуют с оксидами — основными и амфотерными. При этом образуются соль и вода:
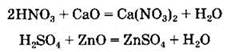
Кислоты взаимодействуют с металлами, стоящими в ряду напряжений металлов до водорода, с образованием соли и водорода:
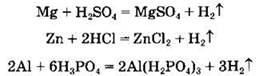
Взаимодействие азотной и концентрированной серной кислот с металлами будет рассмотрено ниже.
В некоторых случаях металлы не взаимодействуют с растворами кислот, хотя стоят в ряду активности металлов до водорода. Так, свинец не реагирует с разбавленной соляной кислотой, хотя растворяется в концентрированной. Это связано с тем, что образующийся в ходе реакции нерастворимый хлорид свинца РbСl2 покрывает металл пленкой и защищает его от действия кислоты.
Кислоты могут взаимодействовать с солями. Этот тип реакций возможен в случае выделения газа, образования осадка или слабого электролита:
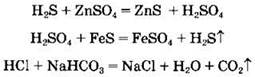
Некоторые кислоты могут разлагаться при нагревании, например:
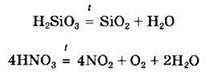
Кислоты могут участвовать не только в кислотно- основных, но и в окислительно-восстановительных реакциях:
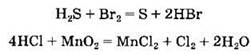
Важным свойством плавиковой кислоты является ее растворяющее действие на стекло, что связано с реакцией с диоксидом кремния, входящим в состав стекла:
![]()
Специфические свойства серной кислоты. Концентрированная серная кислота является довольно сильным окислителем, особенно при нагревании. Так, она окисляет бромид-, иодид-ионы, некоторые простые вещества (серу, уголь) и другие:
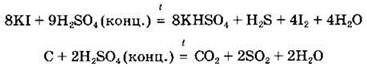
Концентрированная серная кислота может окислять некоторые малоактивные металлы, стоящие в ряду активности после водорода (Сu, Hg, Ag). Поскольку окислителем в данном случае являются не ионы водорода Н+ (как в разбавленном растворе кислоты), a cepa(VI), то в ходе реакции выделяется не водород, а продукты восстановления серы(VI): сероводород, диоксид серы, сера:
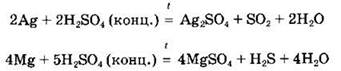
Концентрированная серная кислота не растворяет (пассивирует) такие металлы, как алюминий, железо, хром.
Качественной реакцией на серную кислоту и ее соли является образование белого, не растворимого в кислотах осадка при действии солей бария:
![]()
Специфические свойства азотной кислоты. Азотная кислота, особенно концентрированная, проявляет сильные окислительные свойства. Так, она окисляет сульфиды, сульфиты, многие простые вещества (иод, углерод, фосфор, серу) и т.д.:
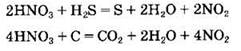
Азотная кислота (даже разбавленная) растворяет многие малоактивные металлы (медь, серебро, ртуть). Поскольку азотная кислота является окислителем за счет азота(V), то продуктом ее восстановления являются различные соединения азота: NO2, NO, N2O, N2, NH4+. Водород, как правило, при взаимодействии металлов с азотной кислотой не выделяется. Состав продукта восстановления азотной кислоты зависит от концентрации азотной кислоты и активности металла. Вероятность выделения NO2 наибольшая в случае использования неактивного металла и концентрированной азотной кислоты. Напротив, образование ионов аммония возможно при растворении в очень разбавленной азотной кислоте активного металла:
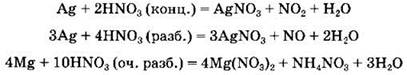
Концентрированная азотная кислота не растворяет (пассивирует) такие металлы, как алюминий, железо, хром.
Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Химические свойства солей определяются природой катиона и аниона, из которых соль образована.
В водных растворах или расплавах соли диссоциируют на составляющие ионы:
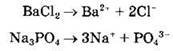
Как правило, соли являются сильными электролитами. Это справедливо и для практически нерастворимых солей типа BaSO4, Са3(РO4)2, CaF2:
![]()
Рассмотрим теперь некоторые из реакций с участием солей.
Соли могут вступать в реакции ионного обмена с кислотами, основаниями и другими солями. Непременным условием возможности протекания таких реакций является выделение газа, образование осадка или слабого электролита. Рассмотрим примеры таких реакций:
— вытеснение слабой кислоты из ее соли под действием более сильной кислоты:
![]()
— образование осадка малорастворимого основания при действии щелочи на соль:
![]()
— выделение газообразного продукта в ходе реакции:
![]()
— образование осадка при взаимодействии двух солей:
![]()
В ряде случаев при взаимодействии солей с кислотами или основаниями могут получиться кислые или основные соли, например:
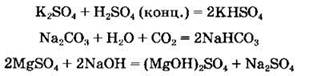
Соли могут вступать в реакции замещения с металлами. В ходе этих реакций более активный металл вытесняет менее активный из раствора его соли:
![]()
Для предсказания возможности таких реакций необходимо использовать электрохимический ряд стандартных электродных потенциалов (ряд напряжений металлов). Так, металлический свинец может вытеснять из солей такие металлы, как медь, серебро, золото. В свою очередь, свинец может быть выделен из своих солей под действием магния, марганца, цинка.
Следует отметить, что не всегда возможна ожидаемая реакция вытеснения одного металла другим на основании положения этих металлов в ряду напряжений. Так, металлический калий при внесении в раствор хлорида цинка в первую очередь будет взаимодействовать с водой с образованием щелочи:
![]()
Образовавшаяся щелочь с солью цинка даст осадок гидроксида цинка:
![]()
Таким образом, выделения цинка происходить не будет.
Реакции вытеснения одних металлов другими могут идти не только в растворе. Так, впервые металлический алюминий был получен вытеснением алюминия калием из расплавленного хлорида алюминия:
![]()
Соли могут участвовать в окислительно-восстановительных реакциях. Одни соли проявляют сильные восстановительные свойства, другие — окислительные. Сильными восстановителями являются SnCl2, CrCl2, FeCl2, CuCl, K2S, K2SO3 и др. Окислительные свойства проявляют КМnO4, K2Cr2O7, KNO3, КСlO3 и др. Примеры окислительно-восстановительных реакций с участием солей:
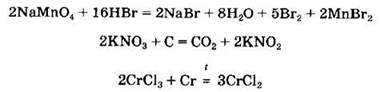
Некоторые соли (главным образом, соли кислородсодержащих кислот) разлагаются при нагревании. К таким солям относятся карбонаты, нитраты, перманганаты, хлораты, перхлораты, дихроматы и др.:
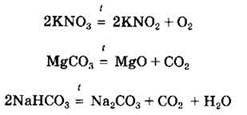
Если первая реакция относится к окислительно-восстановительным, то две последние происходят без изменения степеней окисления.
Разлагаются при нагревании и соли бескислородных кислот, например галогениды:
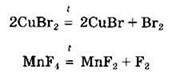
Некоторые соли могут взаимодействовать с кислотными оксидами:
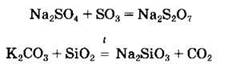
В первой реакции при взаимодействии сульфата натрия и оксида серы (VI) образуется дисульфат (или пиросульфат) натрия — соль дисерной кислоты Na2S2O7, входящей в состав олеума. Во второй реакции диоксид кремния вытесняет более летучий диоксид углерода из силиката калия.
Кислые соли под действием оснований могут быть переведены в средние:
![]()
Средние соли под действием кислот могут быть переведены в кислые:
![]()
Растворы некоторых кислых солей могут взаимодействовать с металлами с выделением водорода:
![]()
Комплексными называют соли, в состав которых входят сложные катионы или анионы, образующиеся при взаимодействии более простых по составу частиц, например:
Na[Al(OH)4] — тетрагидроксоалюминат натрия
К3[Аl(ОН)6] — гексагидроксоалюминат калия
[Cu(NH3)4]SO4 — сульфат тетраамминмеди(II)
В первой соли существует комплексный анион [Аl(ОН)4]-, в котором ион алюминия тетраэдрически окружен четырьмя гидроксид-ионами. В последнем случае в состав соли входит комплексный катион [Cu(NH3)4]2+, в котором ион меди координирует 4 молекулы аммиака.
Гидроксокомплексы легко образуются при взаимодействии амфотерных гидроксидов с водными растворами щелочей. В зависимости от соотношения количеств взятых реагентов и концентрации раствора щелочи могут образоваться гидроксокомплексы разного состава:
![]()
В водном растворе гидроксокомплексы неустойчивы и часто полностью гидролизуются с образованием осадка амфотерного гидроксида. Существование таких солей в растворе возможно только при большом избытке щелочи.
Кислотами гидроксокомплексы полностью разлагаются:
![]()
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ
Все химические свойства уже были охарактеризованы в теоретическом материале, посвященном неорганической химии.
Следует запомнить, что между основными классами неорганических соединений (простыми веществами, оксидами, кислотами, основаниями и солями) существует генетическая связь, под которой подразумевается возможность их взаимного перехода.
Генетическую связь можно представить следующей упрощенной схемой:
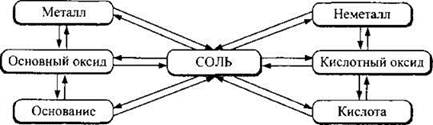
Так, соль бромид алюминия АlВr3 можно получить разными способами, среди которых:
• взаимодействие металла и неметалла:
![]()
• взаимодействие оксида металла с кислотой:
![]()
• взаимодействие металла с кислотой:
![]()
Обратите внимание, что стрелки на схеме направлены в обе стороны. Это значит, что все превращения можно провести и в обратном направлении. Так, из бромида алюминия можно вновь выделить металлический алюминий:
![]()
Следует иметь в виду, что получение многих веществ в химии осуществляется не прямым, а косвенным методом. Так, при получении гидроксида алюминия из оксида нельзя использовать взаимодействие оксида с водой (эти вещества не взаимодействуют), в этом случае необходимо осуществить реакции: