Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Характерные химические свойства углеводородов - Теоретический материал - ОРГАНИЧЕСКАЯ ХИМИЯ
Алканы
Предельные углеводороды — алканы — вступают в реакции замещения и не вступают в реакции присоединения. В то время как практически для всех непредельных соединений, т.е. веществ, содержащих двойные и тройные связи, этот тип реакций является наиболее характерным.
1. Реакции замещения
а) Галогенирование:
![]() где hv — формула кванта света хлорметан
где hv — формула кванта света хлорметан
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения двух, трех и четырех атомов водорода:
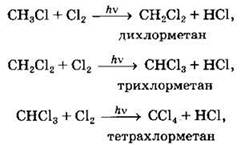
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Рассмотрим механизм радикального замещения на примере монохлорирования метана:
Стадия 1 — зарождение цепи — появление в зоне реакции свободных радикалов. Под действием световой энергии гомо- литически разрушается связь в молекуле Cl: Сl на два атома хлора с неспаренными электронами (свободные радикалы):
![]()
Стадия 2 — рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
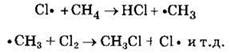
Стадия 3 — обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
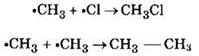
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при хлорировании пропана основным продуктом реакции является 2-хлорпропан:
![]()
б) Нитрование алканов (реакция Коновалова)
На алканы воздействуют разбавленной азотной кислотой при нагревании (140-150 °С) и давлении. В результате происходит замещение атома водорода на остаток азотной кислоты — нитрогруппу NO2. Эту реакцию называют реакцией нитрования, а продукты реакции — нитросоединениями.
Схема реакции:
![]()
2. Реакции окисления
а) все алканы горят с образованием углекислого газа и воды:
![]()
б) частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С—С и С—Н:
![]()
В результате реакций окисления, в зависимости от строения алкана, могут быть получены и другие вещества: кетоны, альдегиды, спирты.
3. Реакции изомеризации (с участием катализатора АlСl3):
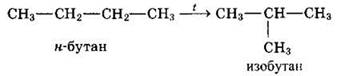
4. Реакции разложения:
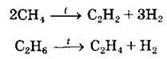
Циклоалканы
Химические свойства циклоалканов во многом зависят от числа атомов углерода в цикле. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28', свойственного sр3-гибридизованному атому углерода. Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
Малые циклы (С3—С4) довольно легко вступают в реакции гидрирования:
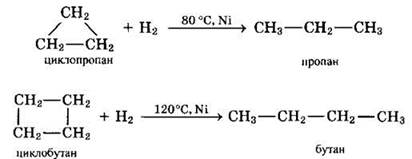
Циклопропан и его производные присоединяют галогены и галогеноводороды:
Для циклоалканов (С5 и выше) вследствие их большей устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
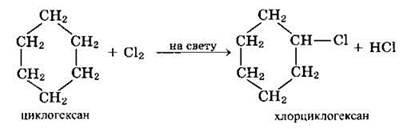
Хлорирование циклогексана идет по цепному механизму (подобно замещению в алканах):
![]()
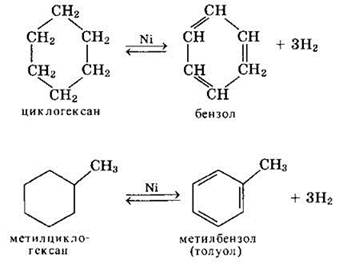
Эти соединения, подобно алканам, вступают также в реакции дегидрирования в присутствии катализатора и др.
Дегидрирование циклогексана и его алкильных производных:
Алкены
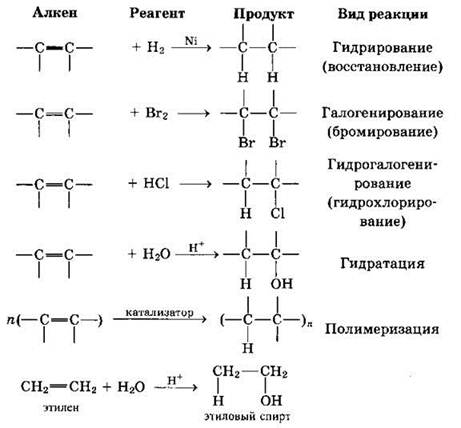
Алкены относятся к непредельным углеводородам. В их молекулах присутствует одна двойная связь (σ-связь и π-связь). Именно с разрывом более слабой π-связи и протекают реакции присоединения.
Алкены вступают в разнообразные реакции присоединения. В качестве реагентов могут выступать молекулы водорода (реакция гидрирования), галогенов (реакция галогенирования), галогеноводородов (реакция гидрогалогенирования), воды (реакция гидратации). За счет разрыва π-связи протекает и реакция полимеризации. В общем виде схемы указанных процессов можно записать следующим образом.
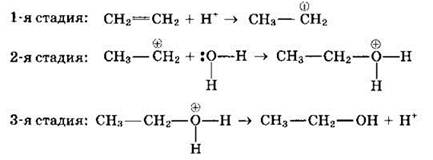
Рассмотрим механизм реакции гидратации, происходящей в присутствии минеральных кислот по механизму электрофильного присоединения1:
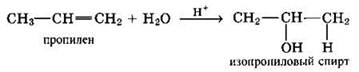
При взаимодействии несимметричных алкенов с молекулами галогеноводородов или воды соблюдается правило В.В. Марковникова: присоединение атома водорода к молекуле несимметричного алкена происходит преимущественно к более гидрогенизированному атому углерода (уже соединенному с большим числом атомов водорода).
Разновидностью реакции присоединения является реакция полимеризации, в ходе которой происходит образование высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
![]()
Число n в формуле полимера (Мn) называется степенью полимеризации. Реакции полимеризации алкенов идут за счет присоединения по кратным связям:
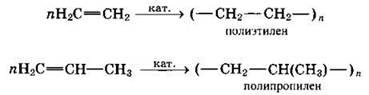
Алкены вступают в реакции окисления, например с перманганатом калия.
В нейтральной и кислой среде реакции идут по-разному.
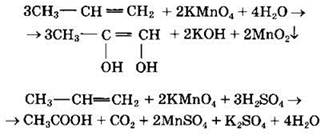
Алкадиены (диены)
Свойства алкадиенов (диенов) аналогичны свойствам алкенов. Главное отличие в их свойствах связано с наличием двух двойных связей в молекулах, причем важную роль играет именно их расположение. Наибольший интерес представляют сопряженные алкадиены (т.е. имеющие сопряженные двойные связи (разделенные одной σ-связью). Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно непрерывной последовательностью четырех sp2-атомов углерода, например, бутадиен-1,3: СН2= СН — СН =СН2
Рассмотрим химические свойства диенов.
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:
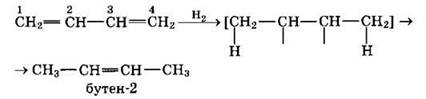
В присутствии катализатора Ni получается продукт полного гидрирования:
![]()
2. Галогенирование — происходит аналогично реакции гидрирования. Преимущественно атомы галогенов присоединяются к первому и четвертому атомам углерода (присоединение-1,4):
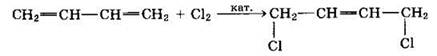
В качестве побочного процесса протекает 1,2-присоединение:
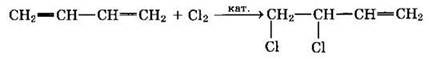
При избытке хлора присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрахлорбутана.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
К реакциям присоединения относятся реакции полимеризации, характерные для диенов. Этот процесс имеет важное значение в производстве синтетических каучуков.
Полимеризация 1,3-диенов может протекать либо по типу 1,4-присоединения, либо по смешанному типу 1,2- и 1,4-присоединения. Направление присоединения зависит от условий проведения реакции.
Первый синтетический каучук, полученный по методу С.В. Лебедева при полимеризации дивинила под действием металлического натрия, представлял собой полимер нерегулярного строения со смешанным типом звеньев 1,2- и 1,4-присоединения:
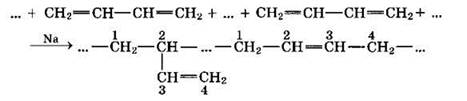
Алкины
Основным типом реакции для алкинов, так же как и для алкенов и диенов, является реакция присоединения.
1. Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород (разрывается первая π-связь) с образованием алкенов, а затем разрывается вторая π-связь, и образуются алканы:
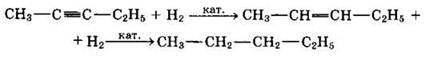
При использовании других (менее активных катализаторов) гидрирование останавливается на стадии образования алкенов.
2. Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
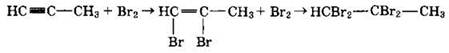
Алкины обесцвечивают бромную воду (качественная реакция).
3. Гидрогалогенирование
Присоединение галогеноводородов к аминам также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом В.В. Марковникова:
![]()
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
![]()
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
4. Гидратация (реакция Кучерова)
Присоединение воды к алкинам происходит в присутствии катализатора соли ртути(II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
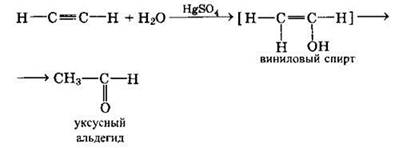
или в кетон (в случае других алкинов):
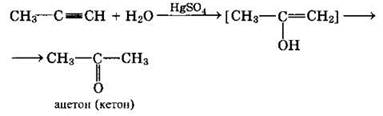
5. Полимеризация
а) Димеризация под действием водно-аммиачного раствора CuCl:
![]()
б) Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
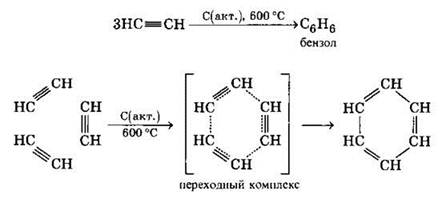
6. Кислотные свойства ацетилена
Ацетилен и его гомологи с концевой тройной связью R—С ≡ С—Н (алкины-1) вследствие полярности связи C(sp)—Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли — ацетилениды:
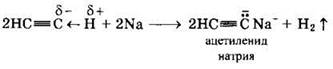
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
При взаимодействии ацетилена (или R—С ≡ С—Н) с аммиачными растворами оксида серебра или хлорида меди(I) выпадают осадки нерастворимых ацетиленидов:
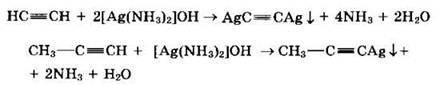
7. Окисление алкинов
Ацетилен и его гомологи легко окисляются различными окислителями (перманганатом калия в кислой и щелочной среде, дихроматом калия в кислой среде и др.). Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
Например, при окислении ацетилена в щелочной среде образуется оксалат:
![]()
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
![]()
![]()
Алкины обесцвечивают разбавленный раствор перманганата калия, что используется для доказательства их ненасыщенности. В этих условиях происходит мягкое окисление без разрыва σ-связи С—С (разрушаются только π-связи). Например, при взаимодействии ацетилена с разбавленным раствором КМnO4 при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты НООС—СООН:
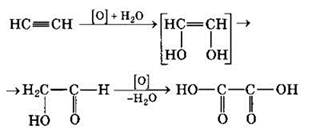
При сгорании алкинов происходит их полное окисление до СO2 и Н2O. Горение ацетилена сопровождается выделением большого количества теплоты:
![]()
Качественной реакцией на непредельные углеводороды служит обесцвечивание бромной воды и раствора перманганата калия (см. раздел 4).