Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Химическая связь и строение вещества - Теоретический материал - ОСНОВЫ ХИМИИ
Под химической связью понимают взаимодействие, приводящее к образованию физически устойчивой двухатомной (межатомной) системы.
Химическая связь образуется за счет валентных электронов. Валентными являются s- и р-электроны внешнего уровня (для непереходных элементов), а также d-электроны предвнешнего уровня (для переходных элементов).
Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Ковалентная связь
Ковалентная связь осуществляется за счет образования общих электронных пар. Существуют два механизма образования ковалентной связи: обменный механизм (или механизм обобществления электронов) и донорно-акцепторный механизм.
В соответствии с первым механизмом ковалентная связь образуется при спаривании электронов, принадлежавших разным атомам. Рассмотрим химическую связь в молекуле водорода Н2. Образование общей электронной пары происходит при взаимодействии двух атомов водорода. Это становится возможным в результате перекрывания s-орбиталей по мере сближения двух атомов:
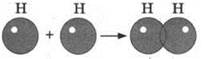
Процесс образования общей электронной пары сопровождается выделением 432 кДж/моль энергии:
![]()
Общую электронную пару в структурных формулах изображают в виде валентного штриха:
![]()
Аналогично образование общей электронной пары происходит и при взаимодействии атомов фтора с конфигурацией 2s22p5 (каждый из которых имеет по одному неспаренному электрону):
![]()
В данном случае химическая связь образуется при перекрывании двух 2р-орбиталей:
![]()
При образовании молекулы НСl общая электронная пара образуется при перекрывании 1s-орбитали атома водорода и 3р-орбитали атома хлора:
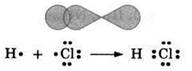
Во всех рассмотренных случаях при сближении атомов происходит частичное перекрывание электронных облаков, при этом в области между ядрами увеличивается плотность электронного заряда, что и приводит к образованию химической связи.
В соответствии со вторым механизмом образования ковалентной связи у одного атома (донора) должна быть неподе- ленная электронная пара, которая взаимодействует с вакантной орбиталью другого атома (акцептора):
![]()
И в этом случае химическая связь обусловлена появлением общей электронной пары, которая до взаимодействия принадлежала одному из атомов.
Донорно-акцепторный механизм образования ковалентной связи реализуется в таких соединениях, как соли аммония, азотная кислота, нитраты, аминокислоты, комплексные соединения. Одна из связей образована по донорноакцепторному механизму в молекулах озона O3 и в ионе гидроксония Н3O+:
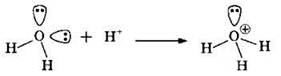
Среди ковалентных связей выделяют связи — полярные и неполярные. Ковалентная неполярная связь образуется между атомами одного и того же химического элемента. Например, в молекулах Н2, O2, Сl2. Во всех подобных молекулах электронное облако связи не поляризовано, т.е. расположено симметрично между двумя связанными атомами. Ковалентная полярная связьобразуется между атомами (обычно неметаллов), отличающимися по электроотрицательности. Например, в молекулах НСl, Н2O, NH3, а также АlСl3, TiCl4 и др. Полярность присуща большинству ковалентных связей.
В указанных выше молекулах связывающее электронное облако смещено к более электроотрицательному атому, вызывая появление частичных положительного и отрицательного зарядов на атомах. Так, в молекуле хлороводорода НСl связывающая электронная пара смещена к более электроотрицательному атому хлора. На атоме водорода при этом появляется частичный положительный заряд δ+ (читается “дельта плюс”), а на атоме хлора — частичный отрицательный заряд δ— (читается “дельта минус”). В результате происходит смещение электронной плотности, которое изображают схематически стрелкой:
![]()
Чем больше разница в электроотрицательностях элементов, тем больше величина зарядов, возникающих на атомах, тем больше полярность связи. Так, в рядах:
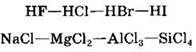
полярность связи уменьшается, поскольку уменьшается разность между значениями электроотрицательностей связанных атомов.
Если между двумя атомами образовалась одна ковалентная связь (одна общая электронная пара), то она называется одинарной. Между двумя атомами могут возникать и кратные связи — двойные (две общие электронные пары) и тройные (три общие электронные пары). В структурных формулах одинарные связи изображаются одним валентным штрихом, двойные связи — двумя валентными штрихами, тройные — тремя. Ниже приведены структурные формулы некоторых молекул (с изображением неподеленных электронных пар, оставшихся на атомах после образования химических связей):
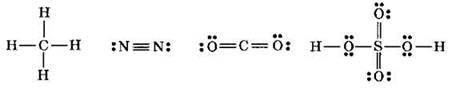
Среди ковалентных связей выделяют, в соответствии с симметрией электронного облака, σ- и п-связи, σ-связи образуются при перекрывании электронных облаков вдоль линии связи.
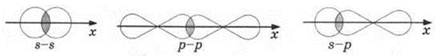
π-связи образуются при боковом перекрывании р- или d-электронных облаков над- и под линией связи:
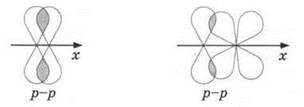
Если между двумя атомами действует одна связь, то это всегда σ-связь. В случае кратной связи между двумя атомами одна из них всегда σ-связь, остальные — π-связи.
Так, в приведенных выше формулах л-связи имеются в молекулах азота (1σ и 2π), углекислого газа (2σ и 2π) и серной кислоты (6σ и 2π). В молекуле метана все атомы связаны только σ-связями (4σ).
Основными характеристиками ковалентной связи являются длина и энергия. Под длиной связи понимают соответствующее межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина. Так, в ряду соединений HF—НСl—НВr—HI происходит увеличение длины связи, вызванное увеличением размера атомов галогенов сверху вниз по подгруппе. В этом же ряду происходит уменьшение энергии химической связи, т. е. уменьшение прочности связи (табл. 2).
Таблица 2
|
Вещества |
HF |
НСl |
НВr |
HI |
|
Длина связи, А |
0,92 |
1,27 |
1,41 |
1,61 |
|
Энергия связи, кДж/моль |
566 |
432 |
366 |
298 |
Энергия связи зависит также от кратности — с увеличением кратности связи ее длина уменьшается, а прочность (энергия) возрастает. Это можно проиллюстрировать примером с углеводородами этаном, этиленом и ацетиленом (табл. 3).
Таблица 3
|
Молекула |
Характеристика связи |
||
|
кратность |
энергия, кДж/моль |
длина, Å |
|
|
Н3С - СН3 |
1 |
264 |
1,54 |
|
Н2С = СН2 |
2 |
423 |
1,35 |
|
HC ≡ CH |
3 |
536 |
1,20 |
Ионная связь
Химическая связь, осуществляемая за счет электростатического взаимодействия разноименно заряженных ионов, называется ионной.
Ионом называют заряженную частицу, которая образуется при присоединении электрона к атому или молекуле или при отдаче электрона атомом или молекулой.
Соединения с ионной связью образуются при взаимодействии атомов, резко отличающихся по электроотрицательности. Например, при реакции щелочных или щелочноземельных металлов с кислородом или галогенами.
Рассмотрим, например, взаимодействие атомов натрия и хлора. Приведем электронные конфигурации этих атомов:
![]()
Видим, что это атомы с незавершенными внешними электронными оболочками. Атому натрия до получения завершенного внешнего уровня легче отдать 1 электрон, чем принять недостающие 7. Атому хлора, наоборот, легче принять недостающий восьмой электрон, чем отдать 7 электронов. Представим это схемами:
![]()
И в одном, и в другом случае получаются ионы с полностью завершенными 8-электронными внешними уровнями. Подобные частицы с полностью завершенными внешними уровнями обладают повышенной устойчивостью, это и является движущей силой образования ионных соединений.
Образовавшиеся ионы Na+ и Cl- взаимодействуют и объединяются в ионную молекулу NaCl:
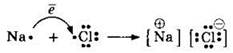
Для примера ионная связь присутствует также в таких соединениях, как KI, CsBr, CaO, BaF2 и др.
Ионные молекулы существуют только в газовой фазе при высоких температурах. В твердом (кристаллическом состоянии) каждый положительно заряженный ион взаимодействует не с одним отрицательно заряженным ионом, а с множеством таких ионов. Это является следствием ненаправленности и ненасыщаемости ионной связи. В результате такого взаимодействия образуются ионные кристаллы, характеризующиеся регулярным, упорядоченным расположением ионов в пространстве. Так, в кристалле поваренной соли каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия.
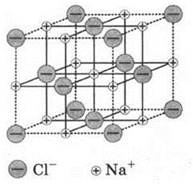
Разумеется, число ионов-“соседей” с противоположным зарядом может быть и иным, однако чередование катионов и анионов в пространстве является для кристаллов обязательным.
Металлическая связь
Металлическая связь осуществляется между атомами с небольшим числом валентных электронов, слабо удерживаемых ядром, и большим числом вакантных валентных орбиталей. Металлическая связь существует в твердых металлах и их сплавах.
В атомах металлов на внешнем уровне находится небольшое число электронов (один-два, реже — три). В то же время имеется относительно большое число свободных орбиталей на внешнем уровне. Так, у атома лития на один внешний электрон приходится три вакантные орбитали, в атоме натрия — на один внешний электрон приходится восемь вакантных орбиталей. Валентные электроны слабо удерживаются ядром и способны свободно перемещаться в пределах всех свободных орбиталей. В результате при образовании кристаллической решетки валентные орбитали соседних атомов перекрываются и электроны свободно перемещаются с одной орбитали на другую в пределах всего кристалла, осуществляя тем самым химическую связь между всеми атомами металла. Так и образуется металлическая связь. Таким образом, твердый металл представляет собой “каркас” из атомов и положительных ионов, находящихся в узлах кристаллической решетки и погруженных в “море” подвижных электронов.
Как и другие виды химической связи, металлическая связь также имеет электростатическую природу.
С особенностями металлической связи связаны такие свойства металлов, как высокие электро- и теплопроводность, характерный металлический блеск, ковкость и пластичность.
Основное отличие металлической связи от ковалентной связано с ненаправленностью металлической связи и ее меньшей прочностью.
Особо отметим, что металлическая связь реализуется только в кристаллических (твердых) металлах.
Водородная связь
Водородные связи возникают преимущественно между молекулами, в состав которых входят атомы водорода и таких наиболее электроотрицательных элементов, как фтор, кислород, азот. Примерами таких веществ могут быть: HF, Н2O, NH3. Смещение общей электронной пары связи Н—X к атому более электроотрицательного элемента X (обозначено стрелкой) приводит к образованию значительного положительного заряда на атоме водорода. Такой атом водорода, взаимодействуя с неподеленной электронной парой соседнего атома Y, притягивает эту пару к себе с образованием второй, более слабой, а именно водородной связи:
![]()
Изображая водородную связь тремя точками, подчеркивают, что она менее прочная, чем обычная ковалентная связь. Несмотря на меньшую энергию водородной связи, именно за счет нее происходит ассоциация многих молекул с образованием димеров, тримеров и т. д., например:
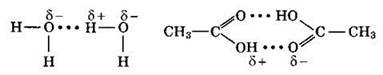
Наличием водородной связи объясняют более высокую точку кипения воды по сравнению с водородными соединениями других элементов VIA группы, а также более высокую температуру кипения спиртов по сравнению с алканами и карбоновых кислот по сравнению со спиртами. Существенно влияние водородной связи и на ряд других свойств органических и неорганических веществ.