Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Электроотрицательность. Степень окисления и валентность химических элементов - Теоретический материал - ОСНОВЫ ХИМИИ
Электроотрицательность
Электроотрицательность — это способность атома в соединении смещать к себе электронную плотность от соседних атомов. На практике часто используют шкалу относительных электроотрицательностей (ЭО) элементов, в которой ЭО лития принята равной 1, а ЭО фтора равна 4.
Таблица 4
|
Период |
Группа |
||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
|
|
1 |
Н 2,1 |
||||||
|
2 |
Li 0,97 |
Be 1,47 |
В 2,01 |
C 2,50 |
N 3,07 |
O 3,50 |
F 4,10 |
|
3 |
Na 1,01 |
Mg 1,23 |
Al 1,47 |
Si 1,47 |
P 2,1 |
S 2,6 |
Cl 2,83 |
|
4 |
К 0,91 |
Ca 1,04 |
Ga 1,82 |
Ge 2,02 |
As 2,20 |
Se 2,48 |
Br 2,74 |
|
5 |
Rb 0,89 |
Sr 0,99 |
|||||
Сопоставляя значения, приведенные в таблице 4, легко заметить, что электроотрицательность химических элементов изменяется периодически: в группе с увеличением заряда ядра ЭО уменьшается, а в периоде — возрастает. Электроотрицательность служит мерой неметалличности элементов — чем больше значение ЭО, тем сильнее элемент проявляет неметаллические свойства и тем менее выражены у него металлические свойства. Используя значения ЭО, можно установить направление перехода электронов в реакциях между простыми веществами. Например, углерод в реакции с водородом выступает как окислитель (принимает электроны), в то время как в реакции с хлором — как восстановитель (отдает электроны):

Это связано с различной ЭО элементов: углерод более электроотрицателен, чем водород, но менее электроотрицателен, чем хлор. Следовательно, чем больше значение ЭО элемента, тем сильнее его окислительные свойства.
Валентность
Валентность характеризует способность атомов данного химического элемента к образованию химических связей. Ранее валентность определяли как число атомов одновалентного элемента, с которым соединяется один атом данного элемента. Так, водород считается типичным одновалентным элементом, кислород — двухвалентным. В настоящее время под валентностью понимают число электронных пар, которыми данный атом связан с другими атомами. Валентные возможности атома определяются числом:
— неспаренных электронов,
— неподеленных электронных пар,
— вакантных валентных орбиталей.
Рассмотрим валентные возможности атомов некоторых элементов.
Атом водорода имеет единственный валентный электрон, что отражает электронная формула 1s1 или графическая формула
![]()
За счет неспаренного электрона атом водорода может образовать только одну ковалентную связь с каким-либо другим атомом X по механизму спаривания (или обобществления) электронов, что изображается графической формулой
![]()
Другие валентные возможности у атома водорода отсутствуют. Поэтому водород проявляет единственную валентность, равную I.
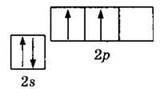
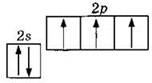
Атом углерода, как элемент IVA группы, имеет четыре валентных электрона, что отражает электронная формула 2s22p2 или графическая формула
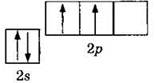
Очевидно, что атом углерода может быть двухвалентным, образуя две ковалентные связи за счет двух неспаренных электронов по механизму обобществления (спаривания) электронов. Однако наиболее многочисленны и устойчивы соединения углерода, в которых его валентность равна IV. Для образования четырех ковалентных связей атом углерода переходит из основного в возбужденное состояние, характеризующееся наличием четырех неспаренных электронов:
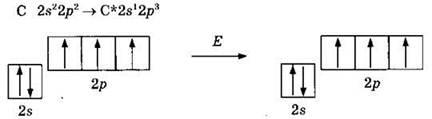
Переход в возбужденное состояние связан с некоторыми энергетическими затратами (примерно 402 кДж/моль), однако эти затраты полностью восполняются при образовании четырех ковалентных связей. Так, при образовании четырех связей С—Н выделяется 1640 кДж/моль, при образовании четырех связей С—F выделяется 1910 кДж/моль.
Валентность IV атом углерода имеет в соединениях: СН4, CF4, СO2, Н2СO3, СН3ОН и многих других.
Отдельно рассмотрим строение молекулы оксида углерода(II). В молекуле СО атом углерода образует три ковалентные связи. Рассмотрим еще раз электронную конфигурацию валентных электронов атома углерода в основном состоянии:
Атом углерода может образовать две ковалентные связи по механизму спаривания электронов (за счет двух неспаренных электронов на 2р-подуровне) и еще одну связь — по донорно-акцепторному механизму (являясь акцептором за счет вакантной 2р-орбитали).
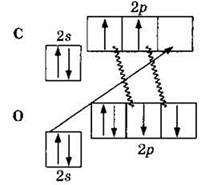
На этой схеме две ковалентные связи, обозначенные волнистыми линиями, образованы по механизму спаривания (за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода), в то время как третья ковалентная связь, изображенная прямой стрелкой, образована по донорно-акцепторному механизму (атом кислорода — донор электронной пары, атом углерода — акцептор). Следовательно, валентность1 углерода в молекуле СО равна III. Отсюда становится понятной современная структурная формула молекулы СО, отражающая ковалентность углерода, равную III:
![]()
В этой формуле знаки “-” и “+” называются формальными зарядами, они показывают, что одна из связей образована по донорно-акцепторному механизму, причем электронная пара переходит с орбитали атома кислорода (поэтому на кислороде “+”) на орбиталь углерода (поэтому на углероде “-”).
Следовательно, атом углерода может проявлять валентности (ковалентности), равные II, III и IV (последняя предпочтительней).
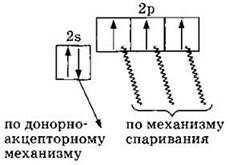
Элемент азот находится во 2-м периоде, в VA группе, следовательно, электронная конфигурация внешнего электронного уровня 2s22p3 или
За счет трех неспаренных р-электронов атом азота может образовать максимально три ковалентные связи по механизму спаривания электронов. Еще одну связь, четвертую, атом азота может образовать по донорно-акцепторному механизму за счет неподеленной 2s-электронной пары (являясь ее донором):
Поскольку во втором энергетическом (квантовом) слое нет вакантных орбиталей, то атом азота не может расспарить 2s2-электронную пару и повысить свои валентные возможности. Таким образом, атом азота может проявлять валентности I, II, III и IV, но не V! Азот не может быть пятивалентным! Даже в азотной кислоте и своем высшем оксиде атом азота образует только четыре ковалентные связи, являясь четырехвалентным, что видно из следующих структурных формул:
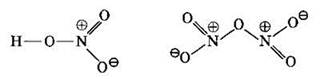
Более точно строение молекулы азотной кислоты передает формула с делокализованной π-связью:
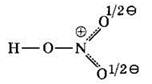
Делокализована не только π-связь, но и формальный заряд на атомах кислорода. Говорят, что в молекуле азотной кислоты кратность концевых связей NO равна 1,5 (1σ и 0,5π). Подобные “полуторные связи” существуют во многих молекулах (например, в озоне O3, бензоле СбН6 и др.).
Элемент фосфор, так же как и азот, находится в VA группе, в третьем периоде. В отличие от атома азота, атом фосфора может увеличить свои валентные возможности. Электронная конфигурация его валентных электронов 3s23p3или:
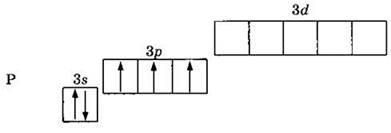
Как и азот, фосфор может проявлять валентности I, II, III и IV. Но, так как для элементов третьего периода доступны вакантные 3d-орбитали, атом фосфора может перейти в возбужденное состояние, переведя один из s-электронов на d-подуровень:
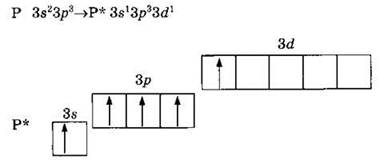
Таким образом, атом фосфора может образовать пять ковалентных связей по механизму спаривания электронов. Валентность V фосфор проявляет в молекулах PF5, Н3РO4, РОСl3 и др.
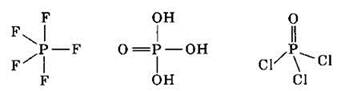
Итак, поскольку существует два механизма образования ковалентной связи (механизм спаривания электронов и донорно-акцепторный механизм), то валентные возможности атомов зависят, в первую очередь, от числа неспаренных электронов в данном атоме, во вторую очередь — от наличия вакантных атомных орбиталей во внешнем уровне, в третью — от числа неподеленных электронных пар. Валентность элементов первого периода не может превышать I, валентность элементов второго периода не может превышать IV.
Степень окисления
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). В отличие от валентности, степень окисления имеет знак — она может быть отрицательной, нулевой или положительной.
Для подсчета степеней окисления имеется несколько простых правил:
1. Степень окисления элемента в составе простого вещества принимается равной нулю. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
2. Некоторые элементы проявляют в соединениях постоянную степень окисления. Среди них: фтор (-1), щелочные металлы (+1), щелочноземельные металлы, бериллий, магний и цинк (+2), алюминий (+3).
3. Кислород, как правило, проявляет степень окисления 2 за исключением пероксидов, например Н2O2 (-1) и фторида кислорода OF2 (+2).
4. Водород в соединении с металлами (в гидридах) проявляет степень окисления 1, а в соединениях с неметаллами, как правило, +1 (кроме SiH4, В2Н6).
5. Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе — заряду этого иона.
6. Высшая положительная степень окисления равна, как правило, номеру группы элемента в Периодической системе. Так, сера (элемент VIA группы) проявляет высшую степень окисления +6, азот (элемент VA группы) — высшую степень окисления +5, марганец — переходный элемент VIIB группы — высшую степень окисления +7. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
7. Низшая отрицательная степень окисления для элементов-неметаллов определяется вычитанием номера группы из числа 8. Так, сера (элемент VI группы) проявляет низшую степень окисления 2, азот (элемент V группы) — низшую степень окисления 3.
На основании приведенных выше правил можно найти степень окисления элемента в любом веществе.
Пример. Найти степень окисления фосфора в кислотах Н3РО2, Н3РО3, Н4Р2O7.
Очевидно, что степень окисления водорода равна +1, кислорода 2. Обозначим степень окисления фосфора как q. Тогда можно записать:
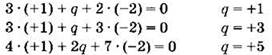
Таким образом, в фосфорноватистой кислоте Н3РO2 степень окисления фосфора равна +1, в фосфористой кислоте Н3РО3 + 3, в пирофосфорной кислоте Н4Р2O7 + 5.
1 В химии наряду с понятием валентность широко используется понятие ковалентность, то есть число ковалентных связей, образуемых данным атомом в молекуле.