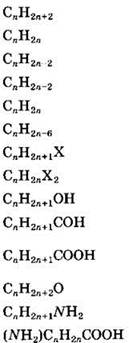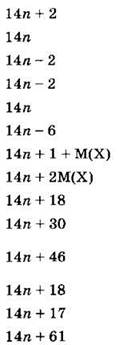Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Расчеты по химическим формулам и уравнениям реакций - Теоретический материал - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей
Массовая доля растворенного вещества равна отношению массы данного вещества А к массе всего раствора:
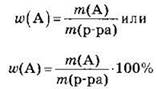
В соответствии с приведенными формулами массовая доля растворенного вещества — величина безразмерная, изменяющаяся в пределах от 0 до 1 или от 0% до 100%.
Поскольку масса раствора складывается из массы растворенного вещества А и массы растворителя:
то расчетные формулы можно переписать в виде:
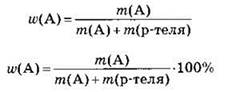
Используя эти формулы, можно рассчитать массу растворенного вещества или массу раствора:
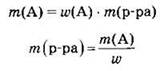
Расчеты объемных отношений газов при химических реакциях
При решении задач часто используют закон объемных отношений газов: объемы газов, участвующих в химической реакции, относятся как их коэффициенты в химическом уравнении.
Так, для химической реакции синтеза аммиака
N2 + 3Н2 = 2NH3
объемы газов относятся как
V(N2): V(H2): V(NH3) = 1:3:2
Использование этого закона упрощает решение химических задач.
Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Решение химических задач предполагает использование понятий “количество вещества” и “моль”. Действительно, в химии взаимодействуют друг с другом не граммы и килограммы, а атомы и молекулы, число которых подсчитывают с использованием количества вещества, выраженного в молях.
При решении любых подобных задач следует в первую очередь записать уравнение химической реакции и внимательно его прочитать.
Пример. Вычислить количество вещества калия, которое без остатка прореагирует с хлором, объем которого при н.у. равен 4,48 л.
Решение. Прежде всего запишем уравнение реакции и прочитаем его:
2К + Сl2 = 2КСl
При взаимодействии 2 моль атомов калия и 1 моль молекул хлора образуются 2 моль хлорида калия.
Итак, по уравнению реакции всегда 2 моль калия реагируют без остатка с 1 моль хлора Сl2.
В условии задачи говорится, что объем хлора равен 4,48 л. Поэтому следующим действием будет нахождение количества вещества хлора. Между количеством вещества газа n, его объемом V и молярным объемом Vm существует простая зависимость:
![]()
Поскольку молярный объем любого газа при н.у. составляет 22,4 л/моль, то формулу (для н.у.) можно переписать в виде:
![]()
В данном случае количество вещества хлора будет равно:
![]()
Теперь следует найти количество вещества калия, которое вступит в реакцию с указанным количеством хлора. Вспомним еще раз, что по уравнению реакции всегда 2 моль К реагируют без остатка с 1 моль С12. Составим пропорцию:
2 моль К — 1 моль Сl2
х моль К — 0,2 моль Сl2
Решая эту пропорцию, находим количество вещества калия:
![]()
Эту величину можно было найти и по-другому. Количества веществ калия и хлора относятся как их коэффициенты в уравнении реакции:
![]()
Отсюда количество вещества калия составит:
![]()
Итак, количество вещества калия, которое полностью про- взаимодействует с 4,48 л хлора, равно 0,4 моль.
Ответ: n(К) = 0,8 моль.
В кратком виде решение этой задачи можно записать так:

Расчеты теплового эффекта реакции
Уравнение химической реакции с указанием теплового эффекта реакции называется термохимическим уравнением. Например, термохимическое уравнение реакции разложения нитрата калия выглядит так:
![]()
Поскольку тепловой эффект зависит от агрегатного состояния веществ, то в термохимических уравнениях в обязательном порядке указывают агрегатные состояния всех веществ.
Пример. Вычислить тепловой эффект реакции полной нейтрализации гидроксида натрия серной кислотой, если при нейтрализации 1 г щелочи выделяется 1,63 кДж теплоты.
Решение. Запишем уравнение реакции:
![]()
Рассчитаем количество вещества щелочи:
![]()
Если при нейтрализации 0,025 моль щелочи выделяется 1,63 кДж теплоты, то при нейтрализации 2 моль щелочи выделится ![]() теплоты. Это количество теплоты и будет тепловым эффектом реакции:
теплоты. Это количество теплоты и будет тепловым эффектом реакции:
![]()
Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
На практике обычно используют не стехиометрические количества веществ — один из реагентов берется в некотором избытке (это может быть связано, в частности, с необходимостью смещения химического равновесия в сторону продукта реакции). Поскольку избыток реагента в реакции не участвует, то химические расчеты следует проводить по веществу, которое полностью вступает в реакцию (иногда говорят, что оно дано в недостатке).
Кроме того, любые из веществ всегда содержат примеси. Массовая доля примесей вычисляется по формуле:
![]()
Пример. Определить массу сульфата бария, образующегося при сливании растворов, содержащих 9,8 г серной кислоты и 25 г хлорида бария.
Решение. Запишем уравнение реакции и рассчитаем количества веществ, взятых для опыта:
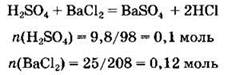
Из уравнения реакции следует, что количества веществ реагентов должны относиться как 1:1. Из расчетов видно, что хлорид бария дан в некотором избытке и не весь вступит в реакцию. Серная же кислота, данная в недостатке, прореагирует полностью. Следовательно, для нахождения количества вещества сульфата бария необходимо использовать количество вещества серной кислоты:
![]()
Ответ: m(BaSO4) = 23,3 г
Пример. Какой объем сероводорода выделится при действии серной кислоты на 26 г сульфида марганца, содержащего 5,7% несульфидных примесей?
Решение. Запишем уравнение реакции:
![]()
Рассчитаем массу сульфида марганца в его техническом образце:
![]()
Количество вещества сульфида марганца составит:
![]()
По уравнению реакции количества веществ сероводорода и сульфида марганца равны:
![]()
Объем сероводорода составит:
![]()
Ответ: V(Н2S) = 6,27 л
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Пример. Сколько граммов соли получится при растворении необходимого количества оксида железа(III) в 486 миллилитрах раствора серной кислоты с массовой долей кислоты 25% и с плотностью 1,21 г/мл?
Решение. Составим уравнение реакции и прочитаем его:
![]()
Один моль оксида железа взаимодействует с тремя молями серной кислоты с образованием одного моля сульфата железа и трех молей воды.
В первом действии найдем массу серной кислоты и количество ее вещества:
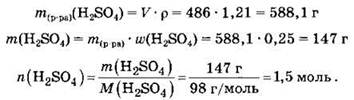
Из уравнения реакции следует, что количество вещества сульфата железа (коэффициент 1) втрое меньше количества вещества серной кислоты (коэффициент 3):
![]()
Следовательно, масса соли составит:
![]()
Ответ: m(Fe2(SO4)3) = 200 г.
Нахождение молекулярной формулы вещества. Установление химической формулы вещества по массовым долям элементов, входящих в его состав
Пример. Установите молекулярную формулу углеводорода, содержащего по массе 81,8% углерода и 18,2% водорода.
Решение. Из условия задачи следует, что в 100 г неизвестного углеводорода содержится 81,8 г углерода и 18,2 г водорода. Найдем количества веществ углерода и водорода в 100 г вещества:
![]()
Отношение количеств веществ углерода и водорода в 100 г этого углеводорода (а следовательно, и в любой другой его порции) равно:
![]()
Ближайшее целочисленное соотношение составит:
![]()
что отвечает формуле пропана С3Н8. Следовательно, это и будет ответ к задаче.
Установление химической формулы вещества по продуктам его сгорания
Пример. При сжигании газообразного углеводорода с плотностью по кислороду 1,312 получено 16,8 л углекислого газа и 13,5 г воды. Определите молекулярную формулу углеводорода.
Решение.
1. Найдем количества веществ углекислого газа и воды:
![]()
2. Найдем количества веществ атомов углерода и водорода и установим простейшую формулу углеводорода:
![]()
Соотношение n(С):n(Н) = 0,75:1,5 = 1:2
Простейшая формула СН2
3. Рассчитаем молярную массу углеводорода (исходя из его плотности) и установим его истинную молекулярную формулу:
молярная масса простейшей формулы равна
М(СН2) = 14 г/моль.
Молярная масса углеводорода, исходя из его плотности, равна ![]() что втрое больше молярной массы простейшей формулы, следовательно, простейшую формулу следует утроить. Окончательно молекулярная формула сгоревшего углеводорода С3Н6.
что втрое больше молярной массы простейшей формулы, следовательно, простейшую формулу следует утроить. Окончательно молекулярная формула сгоревшего углеводорода С3Н6.
Установление химической формулы вещества на основании уравнений реакций с его участием
Пример. Для некоторой предельной одноосновной кислоты массой б г требуется для полной этерификации такая же масса спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
Решение:
1) В первую очередь запишем уравнение реакции этерификации в общем виде и, используя закон сохранения массы веществ в химических реакциях, по разнице найдем массу и количество вещества воды, образовавшейся в реакции:
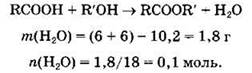
2) Поскольку по уравнению реакции количества веществ кислоты и воды равны, то запишем:
![]()
Теперь можно найти молярную массу кислоты:
![]()
3) Зная молярную массу кислоты, установим ее формулу. Мы знаем, что на радикал R приходится 60 - 12 - 32 - 1 = 15 г/моль. Таким радикалом является метил СН3. Следовательно, кислота имеет формулу СН3СООН.
Установление молекулярной формулы соединения с использованием общей формулы гомологического ряда
При решении задач этого типа полезно знать и использовать общие формулы изучаемых в школьном курсе органической химии гомологических рядов (табл. 12).
Таблица 12
|
Гомологический ряд |
Общая формула |
Молярная масса |
|
Алканы |
|
|
|
Алкены |
||
|
Алкины |
||
|
Диены |
||
|
Циклоалканы |
||
|
Арены |
||
|
Моногалогеналканы |
||
|
Дигалогеналканы |
||
|
Одноатомные спирты |
||
|
Альдегиды |
||
|
Предельные карбоновые одноосновные кислоты |
||
|
Простые эфиры |
||
|
Первичные амины |
||
|
Аминокислоты |
Пример. Установите молекулярную формулу первичного амина, бромоводородная соль которого содержит 63,5% брома.
Решение.
1. Запишем в общем виде уравнение реакции между амином и бромоводородом:
![]()
2. Зная общую формулу солей аминов с бромоводородом, составим алгебраическое выражение для расчета массовой доли брома в такой соли:
![]()
3. Подставим в эту формулу все известные данные, рассчитаем число атомов углерода п в молекуле амина и установим его молекулярную формулу:
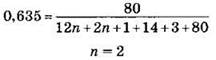
Следовательно, формула амина C2H5NH2.
Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
Большинство химических реакций не доходят до конца. Это связано и с наступлением в системе химического равновесия, и с резким уменьшением скорости реакции в конце взаимодействия, и с другими факторами. В расчетах используют величину выхода продукта от теоретически возможного. Выход продукта равен отношению массы вещества (количества вещества, объема), полученного на практике, к теоретически рассчитанной массе (количеству вещества, объему):
![]()
Очевидно, что практический выход не может быть больше 1(100%).
Пример. При разложении 50 г карбоната кальция было получено 10,5 л (н.у.) углекислого газа. Рассчитайте выход углекислого газа в процентах от теоретического.
Решение. Запишем уравнение химической реакции:
![]()
Найдем количество вещества карбоната кальция:
![]()
Из уравнения реакции следует, что
![]()
Объем углекислого газа должен составить
V(СO2) = 0,5 ∙ 22,4 = 11,2 л. Это теоретический выход.
Практический же выход составит: ![]()