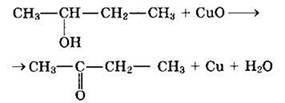Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Задания с комментариями и решениями - Урок 4 - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Задание 1. Верны ли следующие суждения о правилах обращения с веществами?
А. В лаборатории можно знакомиться с запахом и вкусом веществ.
Б. Газообразный хлор очень ядовит.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Обратим внимание, что суждение можно признать верным, если верным является все то, о чем в нем говорится. В первом суждении верным является то, что в лаборатории можно знакомиться с запахом веществ. А вот его вторая часть (знакомство со вкусом) является неверным. Следовательно, первое суждение в целом неверно.
Со вторым суждением о хлоре трудно не согласиться. Всем известно, что хлор — ядовитый газ, попадание которого в легкие приводит к отеку легких. Таким образом, второе суждение верное.
Ответ: 2
Задание 2. Соли аммония можно обнаружить с помощью реакции с
1) гидроксидом натрия
2) серной кислотой
3) хлоридом бария
4) нитратом серебра
Это типичное задание, проверяющее знание качественных реакций на неорганические вещества. В данном случае для обнаружения иона аммония следует использовать взаимодействие его с щелочью:
![]()
Выделившийся аммиак можно распознать либо по характерному запаху, либо по посинению лакмусовой бумаги.
Ответ: 1
Задание 3. Свежеосажденный гидроксид меди(П) является реактивом на
1) карбоновые кислоты
2) одноатомные спирты
3) альдегиды
4) сложные эфиры
Выбрать правильный ответ можно, проанализировав все четыре предложенных варианта ответа. Так, например, известно, что карбоновые кислоты, например уксусная, легко взаимодействуют с гидроксидом меди(II), растворяя его с образованием зеленовато-синего раствора. Казалось бы — это и есть правильный ответ, но это не так. Гидроксид меди(II) взаимодействует не только с карбоновыми, но и другими кислотами — серной, азотной и др.
Реактивом принято считать вещество, при взаимодействии с которым происходит появление или растворение осадка, изменение цвета раствора, выделение газа, и при этом происходящие изменения не должны быть характерны для других представителей данной группы веществ.
Проанализируем другие варианты ответа. Одноатомные спирты и сложные эфиры не взаимодействуют с гидроксидом Меди(II). Остаются альдегиды. Действительно, качественной реакцией на альдегиды, наряду с реакцией серебряного зеркала, является взаимодействие их с гидроксидом меди(II). Голубой осадок свежеосажденного Сu(ОН)2 под действием альдегидов превращается сначала в желтый (СuОН), а затем — в краснокирпичный Сu2O.
Ответ: 3
Задание 4. Для подтверждения качественного состава хлорида алюминия необходимы растворы
1) фосфата калия и бромида серебра
2) нитрата серебра и гидроксида калия
3) нитрата натрия и гидроксида бария
4) хлорида кальция и фенолфталеина
При диссоциации хлорида алюминия образуются ионы алюминия и хлорид-ион:
АlСl3 = Аl3+ + 3Сl-
На хлорид-ион реактивом является ион серебра, т.к. при их взаимодействии образуется белый творожистый осадок хлорида серебра
Cl- + Ag+ = AgCl
На ион алюминия в качестве реактива можно использовать щелочи. При взаимодействии иона алюминия с гидроксид-ионом сначала образуется студенистый осадок, который затем растворяется в избытке щелочи
Аl3+ + 3ОН- = Аl(ОН)3.
Ионы серебра и гидроксид-ионы образуются при диссоциации нитрата серебра и гидроксида калия.
Ответ: 2
Задание 5. С использованием метода “кипящего слоя” в промышленности осуществляют
1) синтез аммиака
2) синтез метанола
3) обжиг колчедана
4) окисление оксида серы(IV)
Метод “кипящего слоя” заключается в том, что через печь для обжига руд снизу пропускают воздух, обогащенный кислородом. В результате чего на поверхности измельченной руды частицы немного подпрыгивают, создавая тем самым “эффект кипения”. В остальных процессах участвуют главным образом, газообразные вещества, в процессе переработки которых метод “кипящего слоя” не используется.
Ответ: 3
Задание 6. Наибольшую экологическую опасность представляет промышленная переработка минерала, содержащего ионы
1) Са2+
2) Fe2+
3) Pb2+
4) Mg2+
Анализируя варианты ответов, необходимо вспомнить, что экологическая опасность чаще всего связывается с воздействием веществ на живую природу, в первую очередь на человеческий организм. С этой точки зрения особо опасными считаются соли тяжелых металлов, в данном случае — свинца. Так, например, при переработке сульфида свинца не только выделяется сернистый газ, но и образуется оксид свинца — а все соединения свинца очень ядовиты. Именно свинцовое производство и представляет наибольшую экологическую опасность!
Ответ: 2
Задание 7. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Проанализируем каждое из суждений. Пирометаллургия (“пирос” — огонь) — это процесс получения металлов из руд с использованием высоких температур. Суждение верное.
И оксид углерода(II), и кокс (обогащенный каменный уголь) являются отличными восстановителями. А поскольку большинство металлов встречается в природе в виде соединений, то их действительно можно получить восстановлением, используя для этого оксид углерода (II) и кокс.
Оба суждения верны.
Ответ: 3
Задание 8. Способом переработки нефти и нефтепродуктов, при котором не происходят химические реакции, является
1) перегонка
2) крекинг
3) риформинг
4) пиролиз
Вспомним, что и крекинг, и пиролиз, и риформинг — различные химические процессы, протекающие с разложением исходных веществ. Крекинг сопровождается разрывом С-С связей. Пиролиз — более глубокое разложение вещества при действии высоких температур. Риформинг предполагает дегидроциклизацию и изомеризацию углеводородов. А вот перегонка — физический способ разделения смеси на отдельные компоненты или фракции. Никаких химических превращений при обычной перегонке не происходит.
Ответ: 1
Задание 9. Мономером для получения поливинилхлорида является
1) хлорэтан
2) хлорэтен
3) хлорпропан
4) 1,2-дихлорэтан
При анализе условия задания обращает на себя внимание название полимера, в котором фигурирует тривиальное название радикала — винил. В то время как в названиях мономеров его нет. Это связано с тем, что они даны по систематической номенклатуре. Вспомним, что название радикалов, соответствующих предельным углеводородам этану и пропану, — этил и пропил.
Винил — это непредельный радикал, имеющий формулу —СН=СН2. Поэтому хлорэтен СН2=СНСl имеет и другое название — хлорвинил. Таким образом, мономером для производства полихлорвинила (поливинилхлорида) является хлорвинил, т.е. хлорэтен.
Ответ: 2
Задание 10. Природным полимером является
1) полиэтилен
2) поливинилхлорид
3) крахмал
4) полистирол
В природе существует очень большое число полимеров. Органические полимеры главным образом входят в состав живых организмов. К таковым относится крахмал. Все остальные полимеры получают в результате химических реакций, следовательно, они не природные.
Ответ: 3
Задание 11. Объем (н.у.) углекислого газа, который теоретически образуется при сжигании 5 л (н.у.) угарного газа, равен
1) 5 л .
2) 2,5 л
3) 7,5 л .
4) 10 л
Для решения задачи следует составить уравнение реакции между угарным газом и кислородом:
2СО + O2 = 2СO2
Дальнейшее решение задачи можно осуществить с помощью пропорции. По уравнению реакции видно, что при сжигании 2 моль угарного газа образуется 2 моль углекислого газа. В соответствии с законом объемных отношений газов при сжигании 5 л этого СО образуется столько же литров СO2.
Ответ: 1
Задание 12. Согласно термохимическому уравнению реакции
![]()
при получении 15,68 л (н.у.) оксида азота(II) количество выделившейся теплоты будет равно
1) 358 кДж
2) 716 кДж
3) 125,3 кДж
4) 22,4 кДж
Из термохимического уравнения следует, что при образовании 2 моль оксида азота(II) выделяется 358 кДж теплоты. В результате решения задачи требуется определить, сколько энергии выделится при образовании 15,68 л оксида азота(II).
Вычислим, какой объем занимают 2 моль оксида азота(II):
![]()
Составляем пропорцию:
![]()
Отсюда ![]()
Решить эту задачу можно и другим способом: сначала найти, сколько моль оксида азота(II) содержится в 15,68 л этого газа. А затем, составив пропорцию, найти тепловой эффект.
Ответ: 3
Задание 13. Определите массу воды, которую надо добавить к 20г 70%-ного раствора уксусной кислоты для получения 3%-ного раствора уксуса.
Ответ:______ г. (Запишите число с точностью до целых.)
Из условия задачи видно, что существуют два раствора — исходный и конечный, полученный в результате разбавления исходного. Определим массу уксусной кислоты в исходном растворе: mв1 = 0,7 ∙ 20 = 1,4 г. Эта же масса вещества будет составлять 3% в конечном растворе. Исходя из этого определим массу конечного раствора: mр2 = 1,4 : 0,03 = 46,7 г. Разность между массами конечного и исходного растворов и будет являться массой добавленной воды: 46,7 - 20 = 26,7. Округляем значение до целых, как требуется в условии, получаем ответ 27.
Ответ: 27
Задание 14. Объем (н.у.) оксида углерода(IV), который необходимо пропустить через раствор гидроксида кальция для получения 8,1 г гидрокарбоната кальция, равен _______ л. (Ответ запишите с точностью до сотых.)
Составляем уравнение реакции: 2СO2 + Са(ОН)2 = Са(НСO3)2. Определяем количество вещества гидрокарбоната кальция: 8,1 : 162 = 0,05 моль. В соответствии с уравнением реакции количество вещества оксида углерода(IV) в два раза больше, то есть 0,1 моль. Вычисляем объем оксида углерода(IV):
0,1 ∙ 22,4 = 2,24 л.
Ответ: 2,24 л
Задание 15. Объем воздуха (н.у.), необходимый для сжигания 32 л (н.у.) угарного газа, равен ______ л. (Запишите число с точностью до целых.)
При чтении условия задания обратите внимание на то, что в задаче требуется найти объем воздуха, а не кислорода. Это означает, что после того, как вы найдете объем кислорода, необходимо учесть, что в воздухе его только 1/5 часть.
Составим уравнение реакции: 2СО + O2 = 2СO2
На основании закона объемных отношений газов в химической реакции можем утверждать, что объем кислорода, необходимый для сжигания окисида углерода(II), будет ровно в 2 раза меньше, т.е. составит 16 л. Но, как мы уже заметили, кислорода в воздухе содержится только 1/5 часть, или 21%, поэтому объем воздуха составит 16/0,21 = 76,19 л. Округляя до целых, окончательно получаем 76 л. Те, кто в расчете использовал примерную долю кислорода в воздухе (1/5, или 20%), получат ответ 16/0,2 = 80 л. И тот и другой ответ (и 76 л, и 80 л) будут признаны в качестве правильных.
Ответ: 76 л (или 80 л)
Задание 16. Смешали 30 мл 8%-ного раствора ацетата серебра (р = 1,04 г/мл) и 24 г 10%-ного раствора H2S. Масса образовавшегося осадка равна ______ г. (Запишите число с точностью до десятых.)
Для решения задачи составим уравнение реакции, т.к. расчеты необходимо вести с учетом коэффициентов:
![]()
Найдем массу раствора ацетата серебра, массу ацетата серебра в растворе и его количество:
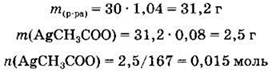
Вычислим массу и количество вещества сероводорода:
![]()
Определим, какой реагент в избытке, а какой — полностью вступит в реакцию. По уравнению реакции количество вещества сероводорода должно быть в 2 раза меньше, чем ацетата серебра. По условию же сероводорода дано в 5 раз больше — он в значительном избытке. Следовательно, расчет ведем по ацетату серебра, который полностью вступит в реакцию:
![]()
Округлив до десятых (в соответствии с условием), получим ответ 1,9 г.
Ответ: 1,9 г
Задание 17. Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (ρ = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
Рассмотрим этапы решения задачи.
1) Составим уравнение химической реакции между магнием и серной кислотой:
![]()
2) Рассчитаем количества и массы веществ, полученных в ходе реакции:
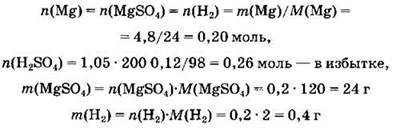
3) Вычислим массу раствора серной кислоты:
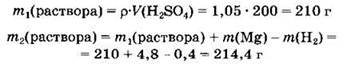
4) В завершение найдем массовую долю сульфата магния в растворе:
![]()
Ответ: 11,2%
Задание 18. При сгорании 9 г бескислородного органического вещества выделилось 2,24 л азота (н.у.). На основании данных условия выполните задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с хлорметаном.
Для решения расчетных задач на установление молекулярных формул веществ полезно знать общие формулы изучаемых в школьном курсе органической химии гомологических рядов, в частности таких:
|
Гомологический ряд |
Общая формула |
|
Алканы |
СnН2n+2 |
|
Алкены |
СnН2n |
|
Алкины |
СnН2n-2 |
|
Диены |
СnН2n-2 |
|
Циклоалканы |
СnН2n |
|
Арены |
СnН2n-6 |
|
Моногалогеналканы |
СnН2n+1Наl |
|
Дигалогеналканы |
СnН2nНаl2 |
|
Одноатомные спирты |
СnН2n+1OH |
|
Альдегиды |
СnН2n+1СОН |
|
Кетоны |
СnН2n+1СО—СnН2n+1 |
|
Предельные карбоновые одноосновные кислоты |
СnН2n+1СООН |
|
Сложные эфиры |
СnН2n+1СОО—СnН2n+1 |
|
Простые эфиры |
СnН2n+2O |
|
Первичные амины |
СnН2n+1NH2 |
|
Аминокислоты |
(NH2)CnH2nCOOH |
Решая данную задачу, прежде всего, составим схему реакции горения органического вещества. С учетом того, что в результате реакции образуется азот, можно утверждать, что вещество относится к азотсодержащим соединениям, например, аминам. Схема реакции позволяет отразить соотношения количества веществ, участвующих в реакции:
![]()
1. Из этой схемы видно, что количество вещества амина вдвое превышает количество вещества образовавшегося азота:
![]()
Теперь можно найти молярную массу амина:
![]()
Так как M(NH2) = 14 + 2 = 16, то на радикал приходится:
М(R) = 45 - 16 = 29.
Таким радикалом может быть только этил С2Н5.
2. Молекулярная формула амина C2H5NH2 (этиламин).
3. Структурная формула СН3—СН2—NH2.
4. Составляем уравнение реакции этил амина с хлорметаном:
![]()
Задание 19. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия выполните задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).
Решение:
1) На первом этапе решения найдем количество вещества продуктов сгорания:
![]()
следовательно, n(С) = 0,8 моль
![]()
следовательно n(Н) = 1 ∙ 2 = 2 моль;
![]()
2) Определяем молекулярную формулу вещества:
Составлено соотношение количеств веществ атомов, образующих вещество:
![]()
Простейшая формула вещества: С4Н10О.
![]()
Молекулярная формула исходного вещества С4Н10О
3) Составлена структурная формула вещества:
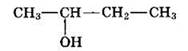
4) Записано уравнение реакции вещества с оксидом меди(II):