Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Задания для самостоятельной работы - Урок 4 - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
1. Растворы фруктозы и глюкозы можно различить с помощью
1) NaOH
2) Cu(OH)2
3) ВаСl2
4) [Ag(NH3)2]OH
Ответ: ![]()
2. Природными полимерами являются
1) полиэтилен
2) поливинилхлорид
3) крахмал
4) полистирол
5) белки
Ответ: ![]()
3. В реакцию “серебряного зеркала” вступает каждое из двух веществ:
1) этановая кислота
2) глюкоза
3) этандиол-1,2
4) метановая кислота
5) сахароза
Ответ: ![]()
4. С использованием метода “кипящего слоя” в промышленности осуществляют
1) синтез аммиака
2) синтез метанола
3) обжиг колчедана
4) окисление оксида серы(IV)
Ответ:
5. Верны ли следующие суждения о моющих средствах?
А. Растворы синтетических моющих средств, как и растворы мыла, имеют щелочную среду.
Б. Синтетические моющие средства не теряют моющих свойств в жесткой воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: ![]()
6. Метан является основным компонентом
1) нефти
2) природного газа
3) попутного нефтяного газа
4) коксового газа
5) синтез-газа
Ответ: ![]()
7. Взрывчатую смесь с воздухом образуют
1) Сl2
2) С2Н2
3) NO2
4) СН4
5) НСl
Ответ: ![]()
8. Для получения аммиака в лаборатории и в промышленности используют
1) хлорид аммония
2) нитрит аммония
3) атмосферный азот
4) анилин
5) азотную кислоту
Ответ: ![]()
9. К реакциям синтеза высокомолекулярных веществ относится
1) гидратация
2) полимеризация
3) гидрогенизация
4) поликонденсация
5) изомеризация
Ответ: ![]()
10. Каучук образуется при полимеризации
1) стирола
2) изопрена
3) бутадиена-1,3
4) бутена-2
5) этилена
Ответ: ![]()
11. Верны ли следующие суждения о правилах обращения с веществами?
А. В лаборатории нельзя знакомиться с запахом веществ.
Б. Соли свинца очень ядовиты.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: ![]()
12. При производстве аммиака в качестве сырья используется
1) синтез-газ
2) метан и воздух
3) метан и оксид углерода(II)
4) азот и водород
Ответ: ![]()
13. Какой объем (н.у.) кислорода потребуется для полного сгорания 10 л (н.у.) ацетилена?
1) 20 л .
2) 5 л
3) 50 л .
4) 25 л
Ответ: ![]()
14. Объем (н.у.) углекислого газа, который теоретически образуется при сжигании 11,2 л (н.у.) угарного газа, равен _____ л. (Запишите число с точностью до десятых.)
15. Согласно термохимическому уравнению реакции
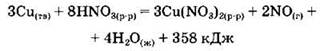
при получении 15,68 л (н.у.) оксида азота (II) количество выделившейся теплоты будет равно _____ %. (Запишите число с точностью до десятых.)
16. К раствору хлорида кальция массой 140 г с массовой долей 5% добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна __________. (Запишите число с точностью до десятых.)
17. В результате реакции, термохимическое уравнение которой
![]()
выделилось 5,74 кДж теплоты. Объем (н.у.) получившегося при этом кислорода составил ______ л. (Запишите число с точностью до десятых.)
18. Объем (н.у.) водорода, теоретически необходимый для синтеза 100 л (н.у.) аммиака, равен ________ л. (Запишите число с точностью до целых.)
19. В соответствии с термохимическим уравнением
![]()
1206 кДж теплоты выделяется при горении угля масссой _______ г. (Запишите число с точностью до целых.)
20. При обжиге сульфида цинка было получено 0,5 моль оксида цинка. Какой объем (н.у.) оксида серы (IV) образовался в результате этого процесса?
Ответ:______ л. (Запишите число с точностью до десятых.)
21. К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Массовая доля соли в полученном растворе равна _______ %. (Запишите число с точностью до десятых.)
22. Какой объем (н.у.) оксида серы (IV) вступил в реакцию с избытком раствора гидроксида натрия, если при этом образовался сульфит натрия количеством вещества 0,2 моль?
Ответ:___________ л. (Запишите число с точностью до сотых.)
23. Масса уксусной кислоты, которая содержится в 0,5 л раствора СН3СООН с массовой долей 80% (плотность 1,1 г/мл), равна ______ г. (Запишите число с точно стью до целых.)
24. Какой объем (н.у.) сероводорода выделился при взаимодействии 0,3 моль сульфида железа (II) с избытком соляной кислоты?
Ответ:___________ л. (Запишите число с точностью до сотых.)
25. Смешали 300 г раствора с массовой долей соли 20% и 500 г раствора с массовой долей 40%. Массовая доля соли в полученном растворе равна ______ %. (Запишите число с точностью до десятых.)
26. Какая масса брома выделится при взаимодействии 0,3 моль бромида калия с избытком хлора?
Ответ:___________ г. (Запишите число с точностью до целых.)
27. К 50 г раствора хлорида кальция с массовой долей 4% добавили 1 г этой же соли и 10 г воды. Массовая доля соли в полученном растворе равна ______ %. (Запишите число с точностью до десятых.)
28. Объем (н.у.) газа, выделившегося при растворении 44 г сульфида железа (II) в избытке серной кислоты, равен ______ л. (Запишите число с точностью до десятых.)
29. В результате гидратации 89,6 л (н.у.) ацетилена можно получить раствор ацетальдегида с массовой долей 20%.
Масса полученного раствора равна ________ г. (Запишите число с точностью до целых.)
30. Масса соли, образовавшейся при растворении оксида железа (III) массой 80 г в избытке азотной кислоты, равна _______ г. (Запишите число с точностью до целых.)
31. К 100 мл 5%-ного раствора соляной кислоты (плотностью 1,02 г/мл) добавили 6,4 г карбида кальция. Сколько миллилитров 15%-ной азотной кислоты (плотностью 1,08 г/мл) следует добавить к полученной смеси для ее полной нейтрализации?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
32. В 120 мл раствора азотной кислоты с массовой долей 7% (плотностью 1,03 г/мл) внесли 12,8 г карбида кальция. Сколько миллилитров 20% -ной соляной кислоты (плотностью 1,10 г/мл) следует добавить к полученной смеси для ее полной нейтрализации?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
33. Нитрит калия массой 8,5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
34. Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (ρ = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
35. Рассчитайте, какую массу оксида серы(У1) добавили в 2000 мл 8%-ного раствора серной кислоты (ρ = 1,06 г/мл), если массовая доля серной кислоты стала равной 20%.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
36. Некоторый алкин имеет относительную плотность по воздуху 1,862. Известно, что этот алкин взаимодействует с аммиачным раствором оксида серебра(I).
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с аммиачным раствором оксида серебра(I).
37. Пары некоторого диена имеют относительную плотность по водороду 34. Известно, что при действии небольшого количества брома на диен образуется только одно дибром- производное.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с бромной водой (с учетом недостатка брома).
38. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Известно, что при взаимодействии с азотистой кислотой органическое вещество образует спирт.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с азотистой кислотой.
39. Массовая доля кислорода в органическом соединении равна 42,67%. Известно, что это соединение, реагируя с аланином, образует дипептид.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с аланином.
40. При полном сгорании углеводорода образовалось 27 г воды и 33,6 л СO2 (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Известно, что этот углеводород реагирует с бромоводородом, но не реагирует с водой.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с бромоводородом.