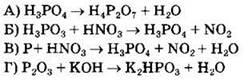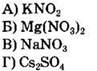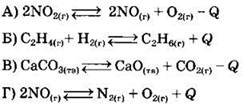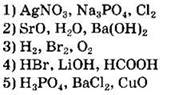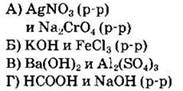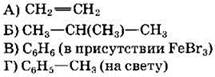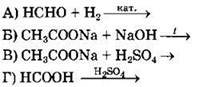Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
ВАРИАНТ 4 - ПРИМЕРНЫЕ ВАРИАНТЫ ЕГЭ
Часть 1
Ответами к заданиям 1-23 является последовательность цифр. Запишите ответ в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
1. Неспаренные электроны в основном состоянии отсутствуют в атомах
1) Аl
2) N
3) Аr
4) Mg
5) С
Ответ: ![]()
2. Атомный радиус меньше, чем у кремния, имеют элементы
1) Аl
2) S
3) С
4) Mg
5) Ge
Ответ: ![]()
3. Водородные связи характерны для
1) NH3
2) Н2
3) СН4
4) Н2СО
5) СН3ОН
Ответ: ![]()
4. Атом азота трехвалентен в соединениях
1) N2O5
2) N2
3) NO
4) NH3
5) NH4Cl
Ответ: ![]()
5. Молекулярное строение имеет каждое из двух веществ
1) С3Н7OН и Н2O
2) СO2 и Са(ОН)2
3) Р2O3 и КНСO3
4) С3Н8 и FeS
5) С2Н6 и NH3
Ответ: ![]()
6. Из приведенных веществ выберите три амфотерных гидроксида
1) Ве(ОН)2
2) Sr(OH)2
3) Сr(ОН)2
4) Сr(ОН)3
5) LiOH
6) Zn(OH)2
Ответ: ![]()
7. Сера может реагировать с
1) С3Н7ОН .
2) СO2 .
3) H2SO4
4) K2SO3
5) НСl
Ответ: ![]()
8. Оксид хрома(III) взаимодействует с
1) водой при обычных условиях
2) карбонатом калия при нагревании
3) азотом при нагревании
4) натрием при обычных условиях
5) серной кислотой при нагревании
Ответ: ![]()
9. Гидроксид алюминия реагирует с каждым из двух веществ:
1) СН4 и СO2
2) HNO3 и С
3) HCl и LiOH
4) Ва(ОН)2 и HF
5) Na2CO3 и Рb
Ответ: ![]()
10. Сульфит натрия реагирует с каждым из двух веществ:
1) КОН и СO2
2) HNO3 и С
3) НСl и LiOH
4) Ва(ОН)2 и HF
5) Вr2 и H2SO4
Ответ: ![]()
11. В заданной схеме превращений
![]()
веществами X и Y являются:
1) Сl2
2) Pb(NO3)2
3) НСl (разб.)
4) HNO3 (конц.)
5) KNOs
Ответ: ![]()
12. Число σ- и π-связей в молекуле этена равно
1) 1
2) 2
3) 3
4) 4
5) 5
Ответ: 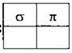
13. В реакцию гидратации вступает каждое из двух веществ:
1) бутен и изобутан
2) пропин и этен
3) ацетилен и Толуол
4) ацетилен и пропан
5) этилен и бутин-2
Ответ: ![]()
14. Оксид меди(II) окисляет пропанол-1 до вещества А, а пропанол-2 - до вещества В. Веществами А и В являются
1) пропаналь
2) пропан
3) пропанон
4) пропановая кислота
5) пропин
Ответ: ![]()
15. Бутанол-1 реагирует с каждым из двух веществ:
1) O2 и НВr
2) С2Н5ОН и КОН (р-р)
3) НСl и С2Н6
4) СuО и К
5) КМnO4 и Сu(ОН)2
Ответ: ![]()
16. Сложный эфир получится при взаимодействии
1) уксусной кислоты и метанола
2) муравьиной кислоты и этана
3) изопропанола и ацетальдегида
4) ацетата калия и бромэтана
5) формиата кальция и серной кислоты
Ответ: ![]()
17. Дипептид образуется при взаимодействии аминоуксусной кислоты с
1) аммиаком .
2) анилином
3) аланином .
4) серином
5) серной кислотой
Ответ: ![]()
18. В заданной схеме превращений
![]()
веществами X и Y являются:
1) NaCl .
2) NaOH .
3) НСl
4) Сl2
5) Н2O
Ответ: ![]()
19. Из предложенного перечня выберите две характеристики реакции взаимодействия азота с водородом.
1) каталитическая
2) обратимая
3) эндотермическая
4) замещения
5) ионного обмена
Ответ: ![]()
20. Для увеличения скорости реакции ![]() следует
следует
1) измельчить железо
2) увеличить концентрацию кислоты
3) добавить катализатор
4) увеличить концентрацию FeCl2
5) повысить давление
Ответ: ![]()
21. Двухступенчатая диссоциация в водном растворе протекает в случае
1) Na2CO3
2) Н2С2
3) H2SO4
4) Na2S
5) Cu(OH)2
Ответ: ![]()
22. Нетоксичным является каждое из двух веществ
1) этанол и фенол
2) аргон и азот
3) бром и сероводород
4) оксид углерода(II) и аммиак
5) водород и вода
Ответ: ![]()
23. Мономерами для промышленного получения ВМС являются
1) бутадиен-1,3 .
2) пропен .
3) ацетилен
4) пропин
5) пентадиен-1,4
Ответ: ![]()
Ответом к заданиям 24-26 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведенными в бланке образцами. Единицы измерения физических величин писать не нужно.____ .
24. Вычислите массовую долю соли в растворе, полученном при смешении 100 г 9%-ного раствора с 200 г 15%-ного раствора этой соли.
Ответ:_________ (запишите число с точностью до целых).
25. При взаимодействии 4,48 л этилена с водородом образуется этан объемом ________ л (н.у.). (Запишите ответ с точностью до сотых).
26. Вычислите массу кислорода, необходимого для полного сжигания 28 г этилена.
Ответ: _________ г (запишите число с точностью до целых).
В заданиях 27-35 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ № 1 без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться..
27. Установите соответствие между названием вещества и классом, к которому это вещество принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА А) анилин Б) этилацетат В) аланин Г) стирол |
КЛАСС |
|
1) углеводороды |
|
|
2) спирты |
|
|
3) простые эфиры |
|
|
4) сложные эфиры |
|
|
5) амины |
|
|
6) аминокислоты |
Ответ: 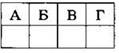
28. Установите соответствие между схемой реакции и свойством фосфора, которое этот элемент проявляет в данной реакции.
|
СХЕМА РЕАКЦИИ
|
СВОЙСТВО ФОСФОРА 1) только окислитель 2) только восстановитель 3) и окислитель, и восстановитель 4) ни окислитель, ни восстановитель |
Ответ: 
29. Установите соответствие между формулой соли и продуктом, выделяющимся на аноде в ходе электролиза водного раствора этой соли.
|
ФОРМУЛА СОЛИ
|
ПРОДУКТ РЕАКЦИИ НА АНОДЕ 1) метан и углекислый газ 2) кислород 3) бром 4) азот 5) этан и углекислый газ 6) водород |
Ответ: 
30. Установите соответствие между формулой соли и средой ее водного раствора.
|
ФОРМУЛА СОЛИ
|
СРЕДА РАСТВОРА 1) нейтральная 2) кислая 3) щелочная |
Ответ: 
31. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ: 
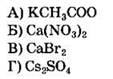
32. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может реагировать.
|
ФОРМУЛА ВЕЩЕСТВА
|
РЕАГЕНТЫ
|
Ответ: 
33. Установите соответствие между формулами взаимодействующих веществ и признаком химической реакции, протекающей между ними.
|
ФОРМУЛА ВЕЩЕСТВ
|
ПРИЗНАК РЕАКЦИИ 1) выделение бесцветного газа 2) растворение осадка 3) образование белого осадка 4) образование окрашенного осадка 5) видимые признаки реакции отсутствуют |
Ответ: 
34. Установите соответствие между формулой вещества и формулой продукта, преимущественно образующегося при взаимодействии вещества с бромом.
|
ФОРМУЛА ВЕЩЕСТВА
|
ФОРМУЛА ПРОДУКТА
|
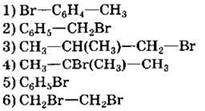
35. Установите соответствие между схемой реакции и названием органического продукта, преимущественно образующегося в ходе реакции.
|
СХЕМА РЕАКЦИИ
|
НАЗВАНИЕ ПРОДУКТА 1) метан 2) метановая кислота 3) этановая кислота 4) угарный газ 5) углекислый газ 6) метанол |
Ответ: 
Часть 2
Для записи ответов на задания 36-40 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (36, 37 и т.д.), а затем его подробное решение. Ответы записывайте четко и разборчиво.
36. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
37. Хлорат калия нагрели в присутствии катализатора. Образовавшуюся соль растворили в воде и раствор подвергли электролизу. На аноде выделился желто-зеленый газ, который пропустили через раствор иодида натрия. Образовавшееся в результате этой реакции простое вещество прореагировало при нагревании с концентрированной азотной кислотой. Напишите уравнения четырех описанных реакций.
38. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
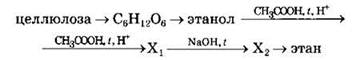
При написании уравнений реакций используйте структурные формулы органических веществ.
39. Красный фосфор массой 4,65 г прореагировал с избытком хлора при нагревании. Полученный продукт растворили в 350 г 20%-ного раствора гидроксида калия. Рассчитайте массовую долю щелочи в образовавшемся растворе.
40. Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием бурого осадка. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.