Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки - Теоретический материал - ОСНОВЫ ХИМИИ
Все вещества могут быть разделены на вещества молекулярного и немолекулярного строения. Если большинство органических веществ имеют молекулярное строение, то неорганические вещества имеют преимущественно немолекулярное (ионное или атомное) строение.
Вещества молекулярного строения (рис. 3) состоят из отдельных молекул. Так, молекулярную природу имеют углеводороды, спирты, карбоновые кислоты, углеводы, многие простые вещества (водород Н2, кислород O2, хлор Сl2, сера S8, белый фосфор Р4), оксиды (СO2, SO2, Н2O), водородные соединения (НСl, HF, NH3), некоторые галогениды (РСl3, TiCl4) и т. д.
Атомы в молекуле связаны между собой прочными ковалентными связями, в то время как между отдельными молекулами действуют слабые межмолекулярные силы. В результате молекулярные кристаллические решетки обладают малой прочностью, а вещества с такими решетками имеют низкие температуры плавления и кипения, не проводят электрический ток.
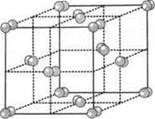
Рис. 3. Молекулярная решетка иода I2
Вещества немолекулярного строения состоят из атомов или ионов и при обычных условиях бывают всегда твердыми. Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из аллотропных модификаций углерода. Кристалл алмаза состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами (рис. 4).
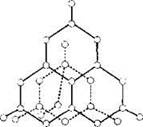
Рис. 4. Кристаллическая решетка алмаза
Отдельных молекул в решетке алмаза нет, весь кристалл представляет собой одну гигантскую молекулу. Атомная кристаллическая решетка характерна для бора, кремния, германия, некоторых карбидов (SiC) и оксидов (SiO2).
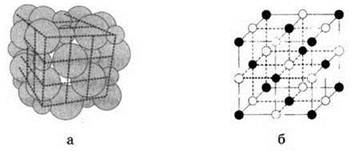
Рис. 5. Кристаллическая решетка хлорида натрия (а) и ее схематическое изображение (б)
Вещества с атомной кристаллической решеткой имеют достаточно высокие температуры плавления, обладают высокой твердостью (кроме графита), нерастворимы в воде или других растворителях, химически мало активны.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл хлорида натрия, в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия (рис. 5).
Очень часто при изображении кристаллических решеток указывают только взаимное расположение частиц, но не их размеры, как это показано на рисунке 56.
Так же, как и в алмазе, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Весь кристалл следует рассматривать как одну гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Сl-. Отдельные ионные молекулы NaCl могут существовать только в газовой фазе при высоких температурах.
Связи между ионами в ионном кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи. Ионные соединения, как правило, легко растворяются в полярных жидкостях (например, в воде), их расплавы и водные растворы проводят электрический ток.
Вещества с металлической связью образуют металлическую кристаллическую решетку, имеют хорошие электро- и теплопроводность, обладают характерным металлическим блеском, ковкостью.