Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
Пример 32. К электролитам относятся каждое из веществ, указанных в ряду:
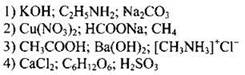
Вещества, которые в растворенном или расплавленном виде проводят электрический ток, называют электролитами. Вещества с ковалентной сильно полярной и ионной связями, как правило, электролиты. Вещества с ковалентной неполярной связью, как правило, неэлектролиты. К этому можно добавить, что все соли, щелочи и многие кислоты - электролиты. Проанализировав состав предложенных веществ, делаем вывод о виде химической связи в них и их принадлежности к классам соединений. Определяем, что правильный ответ 3. В этом ряду представлены кислота, щелочь и соль.
Ответ: 3
Пример 33. В качестве анионов только ионы ОН- образуются при диссоциации
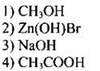
Для выбора правильного ответа вначале выясним, какое из указанных веществ является электролитом, с образованием каких ионов происходит его диссоциация.
Метиловый спирт СН3ОН не является электролитом, поэтому ионов ОН- в его растворе практически нет. Уксусная кислота СН3СООН, хотя и содержит ОН-группы, диссоциирует в водном растворе с образованием не гидроксид-ионов, а ионов водорода Н+:
![]()
Из двух оставшихся соединений только NaOH образует при диссоциации гидроксид-ионы
![]()
Соль Zn(OH)Br диссоциирует согласно уравнению:
![]()
Ответ: 3
Пример 34. Реакция ионного обмена с выпадением осадка и образованием воды происходит между растворами
1) гидроксида натрия и соляной кислоты
2) серной кислоты и гидроксида бария
3) карбоната натрия и азотной кислоты
4) хлорида железа(II) и гидроксида калия
Запишем уравнения происходящих реакций:
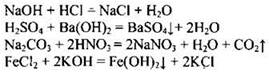
Все записанные реакции представляют собой реакции ионного обмена, но образование осадка и воды происходит только при взаимодействии серной кислоты и гидроксида бария.
Ответ: 2.
Пример 35. Сильным электролитом в водном растворе является вещество, формула которого:
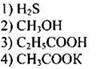
Сильными являются электролиты, практически полностью диссоциирующие в водных растворах на ионы.
Среди приведенных в вариантах ответов веществ есть метанол СН3ОН, который к электролитам не относится. Из оставшихся трех веществ следует исключить слабые кислоты - сероводородную и пропионовую, диссоциация которых в водных растворах протекает лишь в очень малой степени. Оставшееся соединение - ацетат калия - является хорошо растворимой солью, в водном растворе практически полностью распадается на ионы:
![]()
Ответ: 4
Задания для самостоятельной работы
101. Электролитами являются
1) хлорид натрия
2) ацетон
3) сахар
4) оксид кремния
5) идроксид натрия
Ответ: ![]()
102. В водном растворе ступенчато диссоциируют

Ответ: ![]()
103. Наибольшее количество сульфат-ионов образуется в растворе при диссоциации 1 моль
1) сульфата натрия
2) сульфата меди(II)
3) сульфата алюминия
4) сульфата кальция
Ответ: ![]()
104. Какое сокращённое ионное уравнение соответствует взаимодействию растворов фторида калия и нитрата кальция?
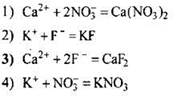
Ответ: ![]()
105. К реакциям ионного обмена относится
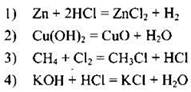
Ответ: ![]()
106. В водном растворе ступенчато диссоциирует

Ответ: ![]()
107. Слабым электролитом является
1) хлороводородная кислота
2) сульфат натрия
3) сероводородная кислота
4) гидроксид лития
Ответ: ![]()
108. К электролитам относятся все вещества, указанные в ряду:
1) гидроксид калия, ацетат калия, серная кислота
2) гидроксид хрома(III), уксусная кислота, этанол
3) хлорид кальция, крахмал, соляная кислота
4) глюкоза, стеарат натрия, карбонат магния
Ответ: ![]()
109. Хлорид-ионы образуются при растворении в воде вещества, имеющего формулу

Ответ: ![]()
110. В водном растворе слабым электролитом является

Ответ: ![]()
111. Наибольшее количество хлорид-ионов образуется в растворе при диссоциации 1 моль
1) хлорида меди(II)
2) хлорида серебра
3) хлорида кальция
4) хлорида алюминия
Ответ: ![]()