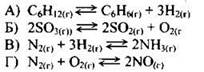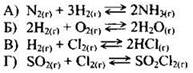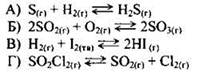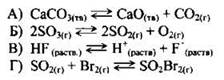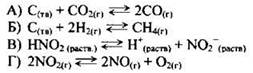Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
В экзаменационных работах прошлых лет усвоение данных элементов содержания проверялось заданиями базового уровня сложности с выбором правильного ответа из четырёх предложенных. Вот примеры подобных заданий.
Пример 27. Химическое равновесие в системе
![]()
смещается в сторону продукта реакции в результате
1) уменьшения температуры
2) уменьшения давления
3) увеличения концентрации СО
4) уменьшения концентрации СO2
Проанализируем действие каждого из факторов на состояние равновесия в этой системе:
1) уменьшение температуры смещает равновесие в сторону протекания экзотермического процесса, в рассматриваемом случае - влево.
2) уменьшение давления смещает равновесие в сторону увеличения объема газов, в данном случае - вправо (т.к. в левой части уравнения фигурирует 1 моль газа, а в правой - 2 моль).
3) увеличение концентрации СО смещает равновесие в сторону его расходования, т.е. влево.
4) уменьшение концентрации СO2 смещает равновесие в сторону его образования, т.е. влево.
Ответ: 2
Пример 28. Изменение давления не смешает равновесие в системе
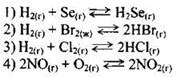
Напомним, что изменение давления сказывается на состоянии равновесия только тех реакций, в ходе которых происходит изменение объема системы. В рассматриваемом задании изменение объема имеет место в реакциях № 1 (2 моль газа → 1 моль газа), № 2 (1 моль газа → 2 моль газа), № 4 (3 моль газа → 2 моль газа). В ходе реакции № 3 объем не изменяется (2 моль → 2 моль). Следовательно, изменение давления не смещает равновесие в системе
![]()
Ответ: 3
В настоящее время усвоение этого элемента содержания проверяется заданиями повышенного уровня сложности с кратким ответом. Ниже разбираются подобные задания.
Пример 29. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
Задание проверяет знание влияния условий на смещение химического равновесия в равновесной системе. В основе теоретических представлений лежит хорошо известный вам принцип Ле Шателье: “Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие, то равновесие смещается в сторону, ослабляющую это воздействие”.
Под внешним воздействием подразумевают изменение концентраций веществ, давления или температуры. Из принципа Ле Шателье следует, что при увеличении температуры равновесие смещается в сторону протекания эндотермического процесса.
В данном примере реакции А, Б и Г являются эндотермическими. Следовательно, при увеличении температуры равновесие будет смещаться в сторону протекания прямой реакции, т.е. в сторону продуктов реакции (ответ 1).
Реакция В является экзотермической. Поэтому при увеличении температуры равновесие будет смещаться в сторону обратной реакции (эндотермической). Правильный ответ - 2.
|
А |
Б |
В |
Г |
|
1 |
1 |
2 |
1 |
Ответ: 1121.
Пример 30. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
При увеличении давления химическое равновесие смещается в сторону уменьшения объёма (следствие принципа Ле-Шателье). Уменьшение объёма происходит в реакциях А), Б) и Г). Следовательно, в этих трёх случаях химическое равновесие смещается вправо, в сторону продуктов реакции (ответ 1). В случае взаимодействия водорода и хлора (реакция В) изменения объёма не происходит (2 моль газа → 2 моль газа). В этом случае смещения химического равновесия практически не происходит (ответ 3).
|
А |
Б |
В |
Г |
|
1 |
1 |
3 |
1 |
Ответ: 1131.
Пример 31. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
При уменьшении давления химическое равновесие смещается в сторону увеличения объёма (следствие принципа Ле-Шателье). Увеличение объёма происходит в только в реакциях В) и Г). Следовательно, в этих двух случаях химическое равновесие смещается вправо, в сторону продуктов реакции (ответ 1). В случае взаимодействия водорода и серы (реакция А), а также при взаимодействии сернистого газа и кислорода (реакция Б), объём уменьшается. В этих случаях химическое равновесие смещается влево, в сторону исходных веществ (ответ 2).
|
А |
Б |
В |
Г |
|
2 |
2 |
1 |
1 |
Ответ: 2211.
Задания для самостоятельной работы
94. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
95. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
|
УРАВНЕНИЕ РЕАКЦИИ
|
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
96. В химической системе установилось равновесие:
![]()
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия под действием этого воздействия.
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ А) добавление катализатора Б) увеличение температуры В) увеличение концентрации хлора Г) уменьшение давления |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
97. В химической системе установилось равновесие:
![]()
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия под действием этого воздействия.
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ А) добавление катализатора Б) увеличение температуры В) увеличение концентрации кислорода Г) уменьшение давления |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
98. В химической системе установилось равновесие:
![]()
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия под действием этого воздействия.
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ А) увеличение давления Б) уменьшение температуры В) увеличение концентрации кислорода Г) добавление катализатора |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
99. В химической системе установилось равновесие:
![]()
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия под действием этого воздействия.
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ А) увеличение давления Б) уменьшение температуры В) увеличение концентрации водорода Г) добавление катализатора |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Ответ:
|
А |
Б |
В |
Г |
100. В химической системе установилось равновесие:
![]()
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия под действием этого воздействия.
|
ВОЗДЕЙСТВИЕ НА СИСТЕМУ А) увеличение давления Б) уменьшение температуры В) уменьшение концентрации кислорода Г) добавление катализатора |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |