Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
Пример 17. Объем сероводорода (н.у.), образующегося при действии избытка серной кислоты на 35,2 г сульфида железа(II), равен ________ л.
Ответ:__________ (Запишите число с точностью до сотых.)
Начать решение задачи следует с составления уравнения реакции:
![]()
Рассчитаем количество вещества сульфида железа:
n(FeS) = 35,2/88 = 0,4 моль.
В соответствии с уравнением реакции сероводорода образуется такое же количество вещества, как и сульфида железа:
n(H2S) = n(FeS) = 0,4 моль (по уравнению реакции).
Следовательно, объем H2S составит 0,4 ∙ 22,4 = 8,96 л.
Ответ: 8,96
Пример 18. При сгорании 140 г железа в 112 л (н. у.) хлора образуется хлорид железа (III) количеством вещества _______ моль.
Ответ: ____________ (Запишите число с точностью до десятых.)
Задача на расчет массы продукта реакции, если одно из исходных веществ взято (дано) в избытке.
Составляем уравнение реакции:
![]()
Находим количество вещества (моль) железа и хлора:
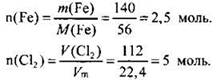
В соответствии с коэффициентами в уравнении реакции их количества должны соотноситься как 2 : 3. Делаем вывод о том, что хлор дан в избытке. Расчет будем вести по железу:
n(Fe) = n(FeCl3) = 2,5 моль.
Ответ: 2,5
Пример 19. 32,15 г алюминия растворили в избытке водного раствора едкого натра. Рассчитайте объем (н.у.) выделившегося в результате этой реакции газа.
Ответ:____________ (Запишите число с точностью до сотых.)
При решении этой задачи следует обратить внимание на правильную запись уравнения реакции. В растворе щелочи алюминий вытесняет из воды водород, образуя комплексную соль - гидроксоалюминат натрия:
![]()
Количество моль алюминия, который вступает в реакцию:
![]()
Согласно уравнению реакции
![]()
Объем выделившегося водорода
![]()
Ответ: 40,32
Задания для самостоятельной работы
61. При растворении карбоната натрия в избытке соляной кислоты выделилось 4,48 л (н.у.) газа. Масса карбоната натрия равна _______ г.
Ответ:_________ (Запишите число с точностью до десятых.)
62. При растворении оксида меди(II) в избытке серной кислоты образовалась соль массой 40 г. Масса оксида меди равна _______ г.
Ответ:_________ (Запишите число с точностью до целых.)
63. Для полного восстановления железной окалины израсходовано 896 л (н.у.) водорода. При этом получено железо массой _______ г.
Ответ:___________ (Запишите число с точностью до целых.)
64. Масса осадка, образовавшегося при сливании раствора, содержащего 52 г хлорида бария, и избытка раствора сульфата натрия, равна _______ г.
Ответ:___________ (Запишите число с точностью до сотых.)
65. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна _______ г.
Ответ:___________ (Запишите число с точностью до целых.)
66. При растворении карбоната натрия в избытке соляной кислоты выделилось 2,24 л (н.у.) газа. Масса карбоната натрия равна _______ г.
Ответ:___________ (Запишите число с точностью до десятых.)
67. Объём (н.у.) оксида серы (IV), который образуется при обжиге 0,2 моль сульфида цинка равен _______ л.
Ответ:___________ (Запишите число с точностью до сотых.)
68. В результате реакции алюминия с соляной кислотой образовалось 0,4 моль соли. Объём (н.у.) водорода, который выделился при этом равен _______ л.
Ответ:___________ (Запишите число с точностью до сотых.)
69. При взаимодействии 32 г карбида кальция с избытком воды образуется ацетилен, объём (н.у.) которого равен _______ л.
Ответ:___________ (Запишите число с точностью до десятых.)
70. При полном термическом разложении 10,1 г нитрата калия образуется газ, объём (н.у.) которого равен _______ л.
Ответ:___________ _(3апишите число с точностью до сотых.)