Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
Пример 20. Сколько литров хлора (н.у.) выделится, если к 200 мл 35%-ной соляной кислоты (плотностью 1,17 г/мл) добавить при нагревании 26,1 г оксида марганца(IV)? Сколько граммов гидроксида натрия в холодном растворе прореагирует с этим количеством хлора? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
В соответствии с условием задачи происходят две химические реакции, которые следует записать
![]()
Далее необходимо провести расчет количества вещества хлороводорода:
n(НСl) = 200 ∙ 1,17 ∙ 0,35/36,5 = 2,24 моль.
Рассчитываем количество вещества оксида марганца, участвующего в реакции:
n(MnO2) = 26,1/87 = 0,3 моль.
Из уравнения реакции видно, что соляная кислота взята в избытке, поэтому расчет объема хлора ведем по оксиду марганца (IV).
![]()
Остается определить массу гидроксида натрия, которая прореагирует с 6,72 л хлора:
![]()
Пример 21. Углекислый газ объёмом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (ρ = 1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
Взаимодействие углекислого газа с гидроксидом натрия может привести к образованию как кислой, так и средней солей. Запишем уравнения этих реакций:
![]()
Чтобы определить какая из солей образуется, надо узнать соотношение количества вещества щелочи и углекислого газа:
![]()
Щелочь дана в избытке, значит, образуется средняя соль.
Количество образовавшейся соли равно количеству углекислого газа в соответствии с уравнением реакции:
![]()
Определим массу образовавшейся соли:
![]()
В полученном растворе кроме средней соли будет присутствовать непрореагировавшая щелочь. Определим её массу:
![]()
Вычислим массу получившегося раствора. Рекомендуем прочитать вновь условие задачи, чтобы “увидеть” массы каких компонентов составят массу получившегося раствора. Это будут масса углекислого газа и масса раствора щелочи:
![]()
Определяем массовые доли веществ в растворе:
![]()
Ответ: w(Na2CO3) = 12,6%, w(NaOH) = 9,48%.
Пример 22. Смесь магниевых и цинковых опилок обработали избытком разбавленной серной кислоты, при этом выделилось 22,4 л (н.у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида натрия, то выделится 13,44 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
Составим уравнения описанных реакций. Учтём, что как магний, так и цинк взаимодействуют с кислотой, а со щелочью реагирует только цинк:
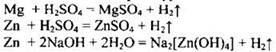
Зная объём водорода, выделившегося в реакции цинка со щелочью, можем определить количество вещества и массу цинка:
![]()
Общее количество вещества водорода, выделившегося в реакции металлов с кислотой равно n(Н2) = 22,4/22,4 = 1 моль.
В реакции с цинком выделится водород количеством вещества n(Zn) = n(Н2) = 0,6 моль, значит 1 - 0,6 = 0,4 моль водорода вытеснит магний. Следовательно, количество вещества магния n(Mg) = n(Н2) = 0,4 моль.
Масса магния m(Mg) = 0,4 ∙ 24 = 9,6 г.
Рассчитаем массовую долю магния в исходной смеси:
![]()
Ответ: ω(Mg) = 19,8%
Задания для самостоятельной работы
71. К раствору, полученному при добавлении 24 г гидрида натрия к 1 л воды, прилили 100 мл 30%- ного раствора азотной кислоты (ρ = 1,18 г/мл). Определите массовые доли веществ в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
72. Карбонат магния массой 8,4 г растворили в 250 мл раствора серной кислоты (ρ = 1,08 г/мл) с массовой долей 15%. Вычислите массовую долю сульфата магния в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
73. Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объем собранного газа. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
74. Карбид кальция массой 6,4 г растворили в 87 мл бромоводородной кислоты (ρ = 1,12 г/мл) с массовой долей 20%. Какова массовая доля бромоводорода в образовавшемся растворе? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
75. Медь, выделившаяся в результате реакции 2,6 г цинка с 160 г 5%-ного раствора сульфата меди (II), полностью прореагировала с 20 мл разбавленной азотной кислоты (ρ = 1,055 г/мл). Определите массовую долю нитрата меди (II) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
76. В раствор, содержащий 51 г нитрата серебра, прилили 18,25 г 20%-ного раствора соляной кислоты. Какая масса 26%-ного раствора хлорида натрия потребуется для полного осаждения ионов серебра из оставшегося раствора нитрата серебра? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
77. Нитрит калия массой 8,5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н. у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
78. В 15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия. Выделившийся при этом метан занял объём 2,24 л (н.у.). Рассчитайте массовую долю серной кислоты в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
79. Какую массу оксида серы(VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
80. Хлорид фосфора(V) массой 4,17 г полностью прореагировал с водой. Какой объём раствора гидроксида калия с массовой долей 10% (плотностью 1,07 г/мл) необходим для полной нейтрализации полученного раствора? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
81. При растворении пероксида лития Li2O2в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
82. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
83. Смесь кремния и алюминия определённой массы обработали избытком разбавленной серной кислоты. При этом выделилось 0,336 л (н.у.) газа. Если эту же смесь обработать избытком раствора гидроксида натрия, то выделится 0,672 л (н.у.) газа. Рассчитайте массовую долю алюминия в исходной смеси. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
84. Оксид алюминия массой 10,2 г сплавили с карбонатом натрия массой 21,2 г. Весь плав растворили в 250 мл хлороводородной кислоты (плотностью 1,10 г/мл) с массовой долей 20%. Рассчитайте массовую долю хлороводорода в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.