Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
ОТВЕТЫ К ЗАДАНИЯМ - ОТВЕТЫ
1.1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Задания с кратким ответом
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
25 |
23 |
24 |
34 |
14 |
15 |
14 |
14 |
314 |
142 |
|
№ |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
ответ |
421 |
341 |
513 |
135 |
142 |
315 |
514 |
234 |
1 |
4 |
|
№ |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
ответ |
4 |
3 |
4 |
4 |
2 |
1 |
14 |
14 |
23 |
15 |
|
№ |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
ответ |
35 |
23 |
35 |
14 |
34 |
6144 |
3345 |
5364 |
4112 |
14 |
|
№ |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
ответ |
4 |
2 |
34 |
4 |
3 |
2 |
1 |
1 |
25 |
23 |
|
№ |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
ответ |
35 |
13 |
14 |
45 |
13 |
34 |
23 |
35 |
25 |
1 |
|
№ |
61 |
62 |
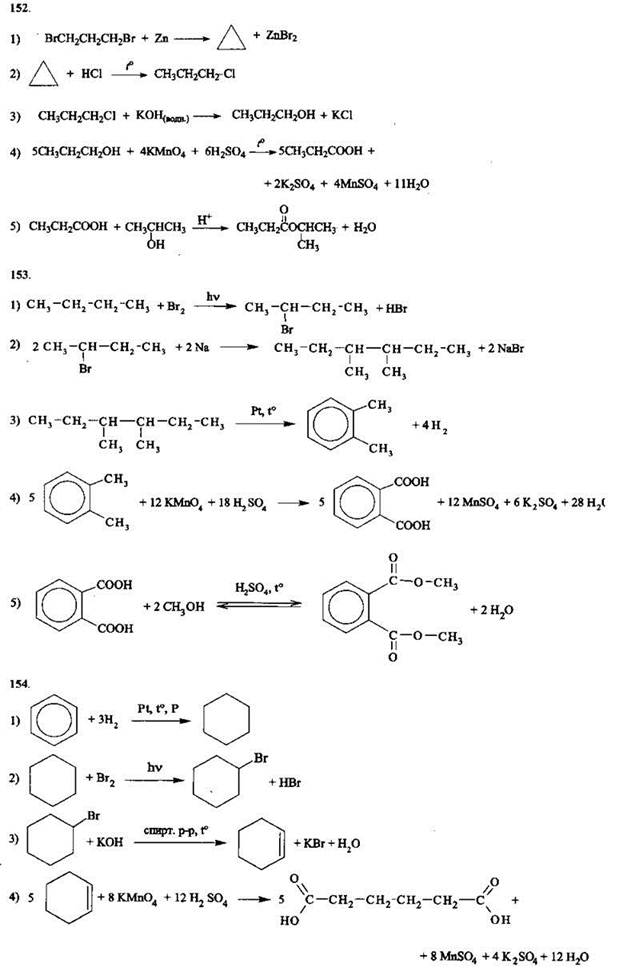
63 |
64 |
65 |
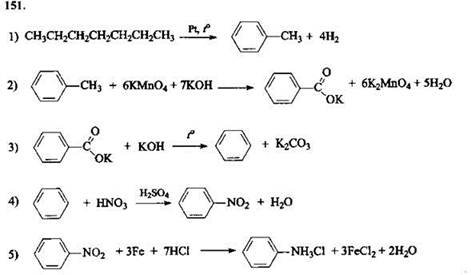
66 |
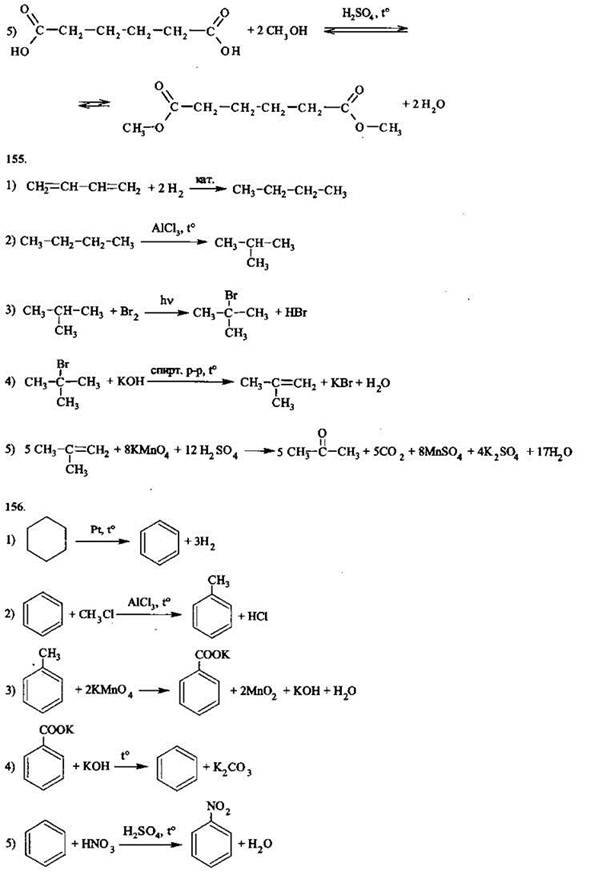
67 |
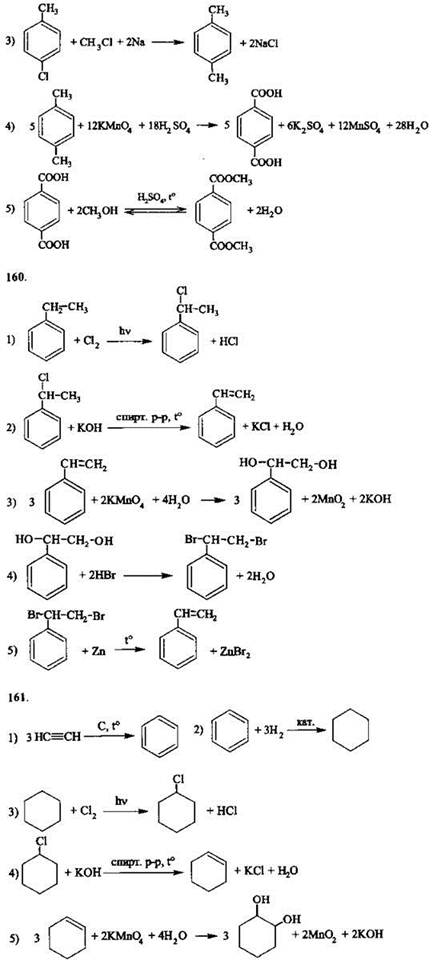
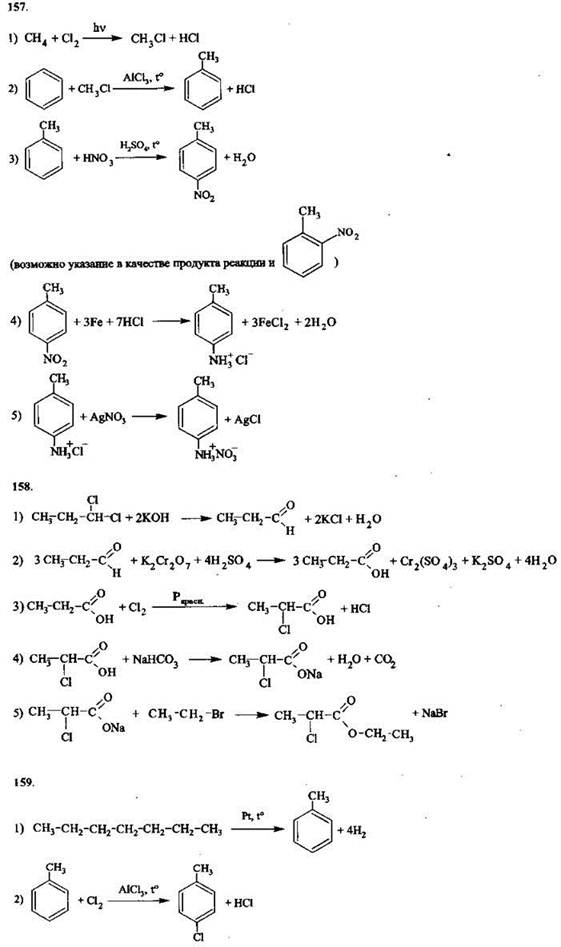
68 |
69 |
70 |
|
ответ |
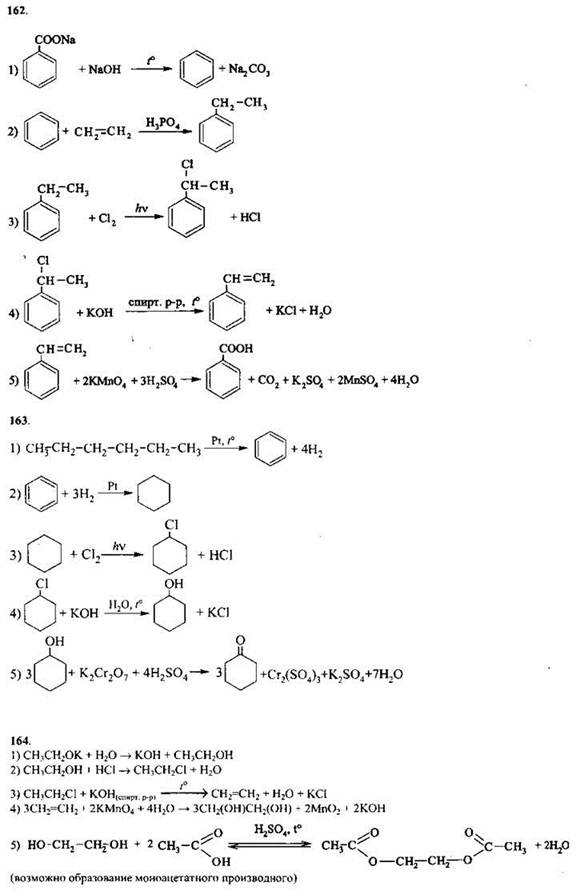
3 |
3 |
3 |
1 |
24 |
34 |
4 |
35 |
23 |
2 |
|
№ |
71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
|
ответ |
14 |
2 |
3 |
1 |
2 |
24 |
13 |
12 |
2 |
45 |
|
№ |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
|
ответ |
3 |
1 |
24 |
24 |
3 |
1 |
45 |
3 |
23 |
2 |
|
№ |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
|
ответ |
3 |
3 |
1 |
2231 |
1232 |
3212 |
3222 |
2123 |
3113 |
1123 |
|
№ |
101 |
102 |
103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
ответ |
15 |
2 |
3 |
3 |
4 |
3 |
3 |
1 |
2 |
2 |
|
№ |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
119 |
120 |
|
ответ |
4 |
1 |
4 |
4 |
1 |
2 |
4 |
3 |
2 |
4 |
|
№ |
121 |
122 |
123 |
124 |
125 |
126 |
127 |
128 |
129 |
130 |
|
ответ |
3 |
1 |
3 |
1 |
1 |
1324 |
2143 |
3142 |
1234 |
4213 |
|
№ |
131 |
132 |
133 |
134 |
135 |
136 |
137 |
138 |
139 |
140 |
|
ответ |
1213 |
1243 |
3214 |
4123 |
3221 |
4312 |
1432 |
2214 |
3 |
1 |
|
№ |
141 |
142 |
143 |
144 |
145 |
146 |
147 |
148 |
149 |
150 |
|
ответ |
3 |
3 |
4 |
4 |
1 |
2 |
2 |
4 |
4 |
3 |
|
№ |
151 |
152 |
153 |
154 |
155 |
156 |
157 |
158 |
159 |
160 |
|
ответ |
1 |
3 |
1345 |
2412 |
1355 |
3215 |
2335 |
3512 |
6451 |
5213 |
|
№ |
161 |
172 |
173 |
174 |
175 |
176 |
177 |
178 |
179 |
180 |
|
ответ |
2221 |
2362 |
2124 |
3511 |
3366 |
1533 |
3653 |
1446 |
2411 |
5541 |
|
№ |
181 |
182 |
183 |
184 |
185 |
186 |
187 |
188 |
189 |
190 |
|
ответ |
1113 |
2623 |
Задания с развернутым ответом
162.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Указано, что сульфат хрома(III) (за счёт хрома в степени окисления +3) является восстановителем, а хлор в степени окисления 0 - окислителем.
3) Определены недостающие в схеме вещества, и расставлены коэффициенты в уравнении реакции:
![]()
163.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что бром в степени окисления -1 (или КВr) является восстановителем, а марганец в степени окисления +7 (или КМnO4) - окислителем.
164.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что сера в степени окисления -2 (или H2S) является восстановителем, а марганец в степени окисления +7 (или КМnO4) - окислителем.
165.
Элементы ответа:
1) составлен электронный баланс:
![]()
2) указано, что железо в степени окисления +2 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) - окислителем;
3) составлено уравнение реакции:
![]()
166.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что фосфор в степени окисления -3 (или РН3) является восстановителем, а серебро в степени окисления +1 (или AgNO3) - окислителем.
167.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что азот в степени окисления - 3 (или NH3) является восстановителем, а марганец в степени окисления + 7 (или КМnO4) - окислителем.
168.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что восстановителем является оксид марганца (IV) (или МnO2), а окислителем - хлорат натрия (или NaClO3).
169.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что фосфор в степени окисления +3 (или оксид фосфора) является восстановителем, а диоксид азота за счет азота в степени окисления +4 - окислителем.
170.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Указано, что иодид калия (за счёт иода в степени окисления -1) является восстановителем, а йодат калия (за счёт иода в степени окисления +5) - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
171.
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Указано, что Fe(OH)3(за счёт железа в степени oкисления +3) является восстановителем, а бром в степени окисления 0 - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
1.2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Задания с кратким ответом
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
214 |
212 |
432 |
321 |
431 |
124 |
135 |
124 |
35 |
134 |
|
№ |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
ответ |
35 |
15 |
123 |
246 |
356 |
246 |
3516 |
3213 |
1253 |
3321 |
|
№ |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
ответ |
3 |
35 |
14 |
1 |
13 |
25 |
35 |
45 |
1 |
3 |
|
№ |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
ответ |
35 |
14 |
35 |
13 |
25 |
45 |
25 |
15 |
14 |
23 |
|
№ |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
ответ |
14 |
3 |
25 |
23 |
15 |
14 |
45 |
45 |
24 |
24 |
|
№ |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
ответ |
15 |
4 |
14 |
35 |
14 |
15 |
24 |
12 |
45 |
25 |
|
№ |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
|
ответ |
24 |
13 |
24 |
3 |
23 |
2 |
12 |
35 |
13 |
25 |
|
№ |
71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
|
ответ |
23 |
34 |
14 |
24 |
2 |
3 |
15 |
35 |
12 |
45 |
|
№ |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
|
ответ |
15 |
34 |
45 |
23 |
13 |
45 |
13 |
14 |
34 |
13 |
|
№ |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
|
ответ |
24 |
23 |
2435 |
6123 |
2346 |
3462 |
4351 |
1453 |
5624 |
6342 |
|
№ |
101 |
102 |
103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
ответ |
3415 |
5123 |
2315 |
1235 |
4421 |
2544 |
1245 |
2433 |
4251 |
5431 |
|
№ |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
119 |
120 |
|
ответ |
41 |
35 |
34 |
24 |
51 |
42 |
42 |
25 |
42 |
45 |
|
№ |
121 |
122 |
123 |
|||||||
|
ответ |
45 |
24 |
52 |
Задания с развернутым ответом
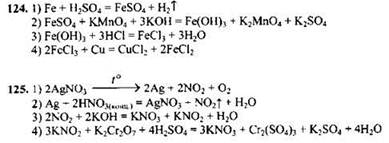

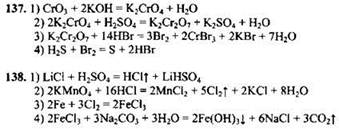
Задания с кратким ответом
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
273 |
423 |
4512 |
3265 |
6451 |
3472 |
3567 |
5341 |
3421 |
3421 |
|
№ |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
ответ |
3 |
12 |
34 |
25 |
24 |
7 |
72 |
35 |
24 |
2 |
|
№ |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
ответ |
13 |
24 |
4 |
25 |
2 |
75 |
3 |
74 |
25 |
73 |
|
№ |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
ответ |
23 |
2 |
3 |
4 |
3 |
3 |
45 |
34 |
45 |
24 |
|
№ |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
ответ |
34 |
35 |
74 |
73 |
24 |
25 |
75 |
75 |
72 |
34 |
|
№ |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
ответ |
23 |
12 |
35 |
24 |
45 |
5567 |
5413 |
5345 |
3126 |
35 |
|
№ |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
|
ответ |
2 |
4 |
34 |
2 |
3 |
7 |
35 |
35 |
73 |
45 |
|
№ |
71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
|
ответ |
13 |
35 |
35 |
74 |
34 |
35 |
45 |
45 |
73 |
24 |
|
№ |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
|
ответ |
23 |
4 |
45 |
25 |
75 |
35 |
74 |
25 |
24 |
72 |
|
№ |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
|
ответ |
13 |
13 |
25 |
73 |
35 |
73 |
25 |
75 |
23 |
23 |
|
№ |
101 |
102 |
103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
ответ |
12 |
2 |
3 |
7 |
.45 |
34 |
35 |
23 |
7 |
7 |
|
№ |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
119 |
120 |
|
ответ |
24 |
45 |
7462 |
4556 |
3452 |
6237 |
3634 |
6436 |
7 |
2 |
|
№ |
121 |
122 |
123 |
124 |
125 |
126 |
127 |
128 |
129 |
130 |
|
ответ |
4 |
2 |
2 |
2 |
7 |
75 |
25 |
4 |
7 |
35 |
|
№ |
131 |
132 |
133 |
134 |
135 |
136 |
137 |
138 |
139 |
140 |
|
ответ |
14 |
25 |
73 |
24 |
75 |
3 |
3 |
34 |
/2 |
24 |
|
№ |
141 |
142 |
143 |
144 |
145 |
146 |
147 |
148 |
149 |
150 |
|
ответ |
13 |
13 |
73 |
34 |
43 |
34 |
35 |
73 |
34 |
74 |
Задания с развернутым ответом


1.4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Задания кратким ответом
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
3 |
4 |
1 |
1 |
45 |
2 |
2 |
13 |
35 |
14 |
|
№ |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
ответ |
35 |
45 |
34 |
2 |
4132 |
2113 |
2414 |
3541 |
3452 |
2151 |
|
№ |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
ответ |
2 |
1 |
4 |
1 |
3 |
3 |
2 |
1 |
1 |
2 |
|
№ |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
ответ |
4 |
24 |
6,25 |
39 |
12,5 |
17,7 |
9,7 |
8 |
8,7 |
18,5 |
|
№ |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
ответ |
118 |
60 |
32 |
26 |
14 |
23,5 |
100 |
60 |
440 |
100 |
|
№ |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
ответ |
14,56 |
44 |
130 |
8,96 |
12 |
2,5 |
3168 |
100 |
1902 |
394 |
|
№ |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
|
ответ |
21,2 |
20 |
1680 |
58,25 |
144 |
10,6 |
4,48 |
13,44 |
11,2 |
1,12 |
Задания с развернутым ответом
71.
1) Составлены уравнения реакций:
![]()
2) Найдено количество вещества гидроксида натрия и азотной кислоты и указано вещество, которое в растворе находится в избытке:
![]()
3) Вычислены масса раствора и массы составляющих его веществ:
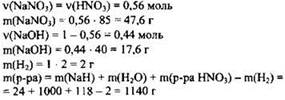
4) Определены массовые доли веществ в растворе:
![]()
72.
1) Составлено уравнение химической реакции:
![]()
2) Рассчитаны массы веществ, полученных в ходе реакции:
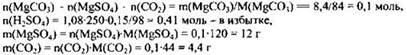
3) Рассчитана масса раствора:
![]()
4) Найдена массовая доля MgSО4:
![]()
73.
1) Составлены уравнения химических реакций:
![]()
2) Определены количества вещества серной кислоты и щелочи:
![]()
3) Рассчитаны количество вещества и масса пероксида натрия:
![]()
4) Определены количество вещества и объем кислорода:
![]()
74.
1) Составлено уравнение химической реакции:
![]()
2) Рассчитаны количества веществ реагентов, сделан вывод об избытке бромоводорода:
![]()
3) Рассчитана масса раствора (с учетом массы выделившегося ацетилена):
![]()
4) Рассчитана массовая доля бромоводорода:
![]()
75.
1) Составлены уравнения реакций:
![]()
2) Рассчитаны количества веществ сульфата меди, цинка и выделившейся меди:
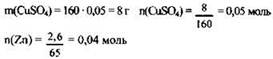
Из уравнения следует, что CuSO4 в избытке, расчет ведется по Zn:
![]()
3) Рассчитаны масса образовавшегося нитрата меди и выделившегося оксида азота:
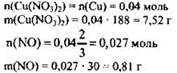
4) Определены масса раствора и массовая доля Cu(NO3)2в нем:
![]()
76.
1) Составлены уравнения химических реакций:
![]()
2) Рассчитаны масса и количества веществ НСl и AgNO3:
![]()
3) Рассчитано количество вещества AgNO3, которое не прореагировало с НСl:
![]()
4) Определена масса раствора NaCl, которая прореагировала с AgNO3:
![]()
77.
1) записано уравнение реакции, и рассчитаны количества исходных веществ:
![]()
2) рассчитан объем выделившегося азота:
![]()
3) рассчитана масса бромида аммония, оставшегося в избытке:
![]()
4) рассчитана массовая доля бромида аммония:
![]()
78.
1) рассчитана масса выделившегося метана:
![]()
2) составлено уравнение реакции серной кислоты с карбидом алюминия и рассчитана его масса:
![]()
3) определена масса прореагировавшей серной кислоты:
![]()
4) рассчитана масса раствора и массовая доля оставшейся кислоты в нем:
![]()
79.
1) составлено уравнение химической реакции:
![]()
2) рассчитана масса серной кислоты, находившейся в исходном растворе и получившейся из х моль оксида серы(IV):
![]()
3) рассчитана масса раствора и суммарная масса серной кислоты в нём:
![]()
4) найдена масса S03, необходимая для растворения:
![]()
80.
1) Записаны уравнения реакций гидролиза хлорида фосфора и нейтрализации двух кислот:
![]()
2) Рассчитаны количество вещества хлорида фосфора(V) и кислот, образовавшихся при гидролизе:
![]()
3) Рассчитаны необходимые количество вещества и масса щёлочи:
![]()
4) Рассчитаны масса и объём раствора щёлочи:
![]()
81.
1) Составлено уравнение реакции пероксида лития с водой, и рассчитано количество вещества пероксида лития:
![]()
2) Рассчитаны количество вещества и масса гидроксида лития и кислорода:
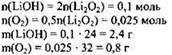
3) Определена масса раствора, и рассчитана массовая доля гидроксида лития в нём:
![]()
4) Записано уравнение реакции избытка углекислого газа со щёлочью, и найден объём углекислого газа:
![]()
82.
1) Записано первое уравнение реакции:
![]()
2) Найдено отношение количества вещества основания и кислоты, записано соответствующее уравнение реакции:
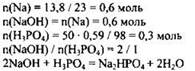
3) Вычислены массы продуктов реакций:
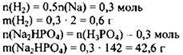
4) Вычислена массовая доля соли в растворе:
![]()
83.
1) Записаны уравнения реакций:
![]()
2) Вычислены количество вещества и масса алюминия в смеси:
![]()
3) Вычислены количество вещества и масса кремния в смеси:
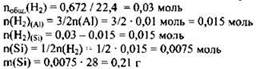
4) Рассчитана массовая доля алюминия в смеси:
![]()
84.
1) Записано уравнение реакции, и рассчитано количество вещества оксида алюминия, карбоната натрия и алюмината натрия:

2) Записано уравнение реакции, и рассчитано количество вещества хлороводорода, прореагировавшего с избытке Na2CO3:
![]()
3) Записано уравнение реакции, и рассчитано количество вещества хлороводорода, вступившего в реакцию с NaAlO2:
![]()
4) Вычислена массовая доля хлороводорода в полученном растворе: ![]()
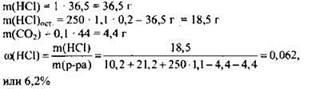
85.
1) Записаны уравнения реакций и указано, что количества веществ галогеналканов равны друг другу:
![]()
2) Составлены алгебраические уравнения для расчетов п галогенпроизводных:
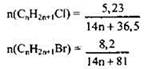
3) Решением алгебраического уравнения найдена молекулярная формула алкена:
![]()
молекулярная формула алкена С3Н6
86.
1) Составлена схема реакции:
![]()
2) Рассчитаны количества моль атомов углерода, водорода и азота в навеске амина:
![]()
3) Установлено соотношение атомов х : у : z = 0,02 : 0,055 : 0,005 = 4 : 11 : 1 определена истинная молекулярная формула амина: С4Н11N.
87.
1) Приведена стехиометрическая схема реакции:
![]() И найдено, что
И найдено, что
![]()
2) Рассчитана молярная масса амина
![]()
3) Определена формула амина т.к на радикал R приходится 59 - (14 + 2) = 43, таким радикалом может быть тол пропил -С3Н7.
молекулярная формула амина - C3H7NH2
88.
1) Составлено уравнение реакции в общем виде, и вычислено количество вещества водорода:
![]()
2) Рассчитана молярная масса спирта:
![]()
3) Установлена молекулярная формула спирта:
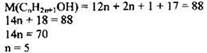
Молекулярная формула спирта - С3Н11ОН
89.
1) найдено количество вещества продуктов сгорания: общая формула вещества CxHyOz
![]()
2) определена молекулярная формула вещества:
![]()
вычисленная формула С4Н10О
MВЫЧ(CxHyOz) = 74 г/моль;
молекулярная формула исходного вещества С4Н10О
3) составлена структурная формула вещества:
![]()
4) записано уравнение реакции вещества с оксидом меди(II)
![]()
90.
1) составлено уравнение гидролиза эфира в общем виде,
![]()
2) найдено количество вещества едкого натра и сложного эфира:
![]()
из уравнения следует, что ![]() тогда
тогда
3) определена молярная масса эфира и его формула:
![]()
M(R1 + R2) = 60 - 12 - 32 = 16 г/моль, следовательно ими могут быть только атом Н и метил СН3
формула эфира НСООСН3
91.
1) Составлено общее уравнение реакции горения газообразного органического вещества:
![]()
2) рассчитаны количества моль атомов углерода, водорода и азота в навеске вещества:
![]()
Установлен состав молекулы вещества:
сумма масс элементов (0,48 + 0,28 + 0,14) равна массе навески вещества (0,90); значит, кислород в веществе отсутствует
3) определена простейшая формула вещества: C2H7N и указана её молярная масса М = 45
Из условия М = 1,607 ∙ 28 = 45 установлена истинная молекулярная формула C2H7N
92.
1) Составлено уравнение реакции в общем виде, и вычислено количество вещества газа:
![]()
2) Рассчитана молярная масса кислоты:
![]()
3) Установлена молекулярная формула кислоты:
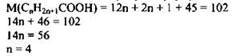
Молекулярная формула С4Н9СООН
93.
1) Найдено соотношение атомов углерода и водорода в углеводороде:
СхНу
![]()
2) Установлена молекулярная формула углеводорода:
0,6 : 1 = 6 : 10
молекулярная формула С6Н10
3) Установлена структурная формула углеводорода с учётом условия задания:
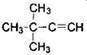
4) Составлено уравнение реакции:
![]()
94.
1) вычислена молекулярная формула углеводорода:
![]()
2) установлена молекулярная формула углеводорода:
![]()
Молекулярная формула углеводорода -С4Н8
3) составлена структурная формула вещества:
СН3-СН=СН-СН3
4) написано уравнение реакции исходного вещества с бромоводородом:
![]()
95.
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
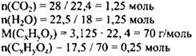
2) Определена молекулярная формула вещества:
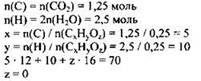
Молекулярная формула вещества - С5Н10
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции получения вещества из третичного спирта:
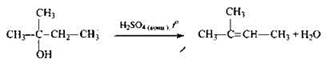
96.
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа и воды:
![]()
2) Определена молекулярная формула вещества:
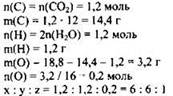
Молекулярная формула - С6Н6O
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции данного вещества с бромной водой:
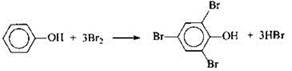
97.
1) Определено число атомов углерода, водорода и кислорода в соединении CxHyOz:
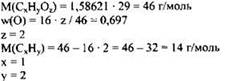
2) Определена молекулярная формула вещества: СН2O2.
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции с пропанолом-2:
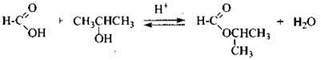
98.
1) Найдены количество вещества углекислого газа и воды:
![]()
2) Определена молекулярная формула вещества:
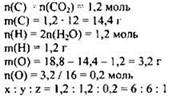
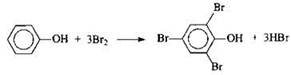
Молекулярная формула - С6Н6O
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции данного вещества с бромной водой:
99.
Общая формула вещества - CxHyOz
1) Найдено соотношение атомов углерода, водорода и кислорода в соединении:
![]()
2) Определена молекулярная формула вещества.
Простейшая формула вещества - СН2O. Учитывая то, что вещество реагирует с оксидом меди(II),
молекулярная формула вещества - С2Н4O2
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции с оксидом меди(II):
![]()