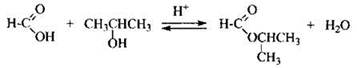Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
ОТВЕТЫ К ВАРИАНТАМ - ОТВЕТЫ
|
№ варианта |
№ задания |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
1 |
35 |
134 |
24 |
24 |
123 |
14 |
35 |
35 |
53 |
3512 |
|
2 |
23 |
354 |
14 |
25 |
413 |
45 |
12 |
15 |
43 |
4436 |
|
3 |
13 |
241 |
35 |
35 |
214 |
23 |
24 |
53 |
21 |
4214 |
|
4 |
23 |
452 |
45 |
25 |
312 |
14 |
24 |
25 |
32 |
4512 |
|
5 |
13 |
315 |
15 |
15 |
143 |
25 |
15 |
23 |
52 |
5622 |
|
№ варианта |
№ задания |
|||||||||
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
1 |
1423 |
243 |
13 |
14 |
34 |
35 |
51 |
5236 |
6436 |
12 |
|
2 |
5123 |
212 |
34 |
15 |
15 |
45 |
41 |
4132 |
3462 |
35 |
|
3 |
1235 |
241 |
14 |
45 |
13 |
25 |
31 |
3156 |
3634 |
13 |
|
4 |
4232 |
412 |
24 |
13 |
35 |
15 |
42 |
2541 |
6231 |
24 |
|
5 |
5142 |
312 |
35 |
45 |
14 |
14 |
31 |
2313 |
1432 |
34 |
|
№ варианта |
№ задания |
||||||||
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
|
|
1 |
12 |
2143 |
2214 |
1231 |
3541 |
5241 |
23,3 |
1,2 |
11,2 |
|
2 |
34 |
1332 |
3122 |
1213 |
2155 |
4125 |
30 |
150 |
43,35 |
|
3 |
25 |
1114 |
2121 |
4123 |
4132 |
5122 |
9,7 |
32 |
21,6 |
|
4 |
34 |
1321 |
1432 |
1322 |
3112 |
3412 |
32 |
3168 |
8,5 |
|
5 |
35 |
1324 |
2323 |
4324 |
2255 |
2134 |
17,7 |
12,5 |
84 |
Ответы на задания с развёрнутым ответом
Вариант 1
30
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Указано, что иодид калия (за счёт иода в степени окисления -1) является восстановителем, а йодат калия (за счёт иода в степени окисления +5) - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
31
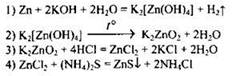
32
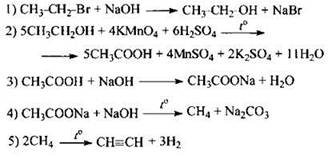
33
Возможно образование С и H2
1) Записано уравнение реакции:
![]()
2) Рассчитаны количество вещества реагентов, и определено вещество, взятое в избытке:
![]()
3) Рассчитаны масса выпавшего осадка и масса образовавшегося при этом раствора:
![]()
4) Рассчитаны масса нитрата бария и его массовая доля в растворе:
![]()
34
Общая формула вещества - CxHyOz
1) Найдено соотношение атомов углерода, водорода и кислорода в соединении:
![]()
2) Определена молекулярная формула вещества.
Простейшая формула вещества - СН2O. Учитывая то, что вещество реагирует с оксидом меди(II),
молекулярная формула вещества - С2H4О2
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции с оксидом меди(II):
![]()
Вариант 2
30
1) Составлен электронный баланс:
![]()
2) Указано, что Fe(OH)3(за счёт железа в степени окисления +3) является восстановителем, а бром в степени окисления окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
31
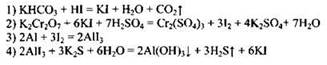
32
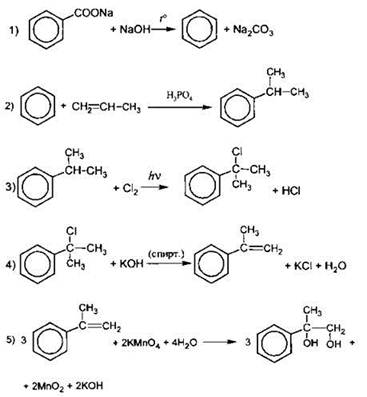
33
1) Записаны уравнения реакций:
![]()
2) Рассчитаны количество вещества щёлочи и хлорида аммония, и сделан вывод об избытке щёлочи:
![]() - щёлочь в избытке, расчёт ведём по хлориду аммония.
- щёлочь в избытке, расчёт ведём по хлориду аммония.
3) Найдены масса аммиака и массовая доля его в растворе:
![]()
4) Рассчитан объём раствора кислоты:
![]()
![]()
34
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
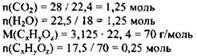
2) Определена молекулярная формула вещества:
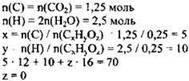
Молекулярная формула вещества - С5Н10
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции получения вещества из третичного спирта:
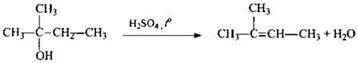
Вариант 3
30
1) Составлен электронный баланс:
![]()
2) Указано, что бромоводород (за счёт брома в степени окисления -1) является восстановителем, а манганат калия (за счёт марганца в степени окисления +6) - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
31
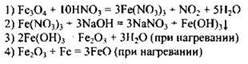
32
33
1) Записаны уравнения реакций гидролиза хлорида фосфора и нейтрализации двух кислот:
![]()
2) Рассчитаны количество вещества хлорида фосфора(V) и кислот, образовавшихся при гидролизе:
![]()
3) Рассчитаны необходимые количество вещества и масса щёлочи:
![]()
4) Рассчитаны масса и объём раствора щёлочи:
![]()
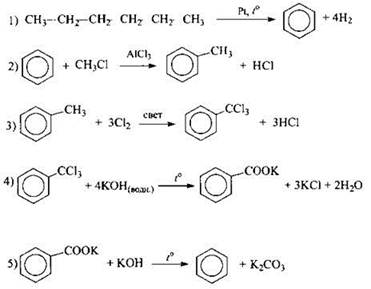
34
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа и воды:
![]()
2) Определена молекулярная формула вещества:
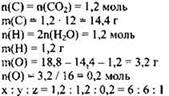
Молекулярная формула - C6H6O
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции данного вещества с бромной водой:
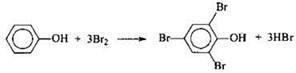
Вариант 4
30
Элементы ответа:
1) Составлен электронный баланс:
![]()
2) Указано, что сульфат хрома(III) (за счёт хрома в степени окисления +3) является восстановителем, а хлор в степени окисления 0 - окислителем.
3) Определены недостающие в схеме вещества, и расставлены коэффициенты в уравнении реакции:
![]()
31
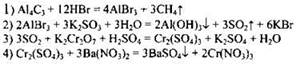
32
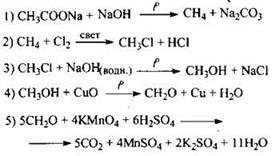
33
1) Составлены уравнения реакций:
![]()
2) Определено количество вещества NH3, и указано, что вода дана в избытке:
![]()
3) Определено количество вещества NH4Cl, и указано, что НСl - в избытке:
![]()
4) Определена массовая доля NH4Cl:
![]()
34
Общая формула вещества - СхНуOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
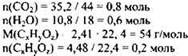
2) Определена молекулярная формула вещества:
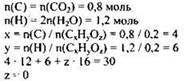
Молекулярная формула - С4Н6
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции этого вещества с избытком бромной воды:
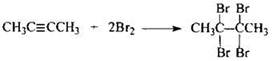
Вариант 5
30
1) Составлен электронный баланс:
![]()
2) Указано, что Na2SO3 (за счёт серы в степени окисления +4) является восстановителем, а КМnO4 (за счёт марганца в степени окисления +7) - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
![]()
31
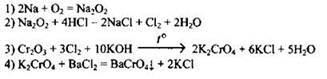
32
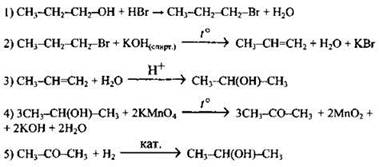
33
1) Составлено уравнение реакции пероксида лития с водой, и рассчитано количество вещества пероксида лития:
![]()
2) Рассчитаны количество вещества и масса гидроксида лития и кислорода:
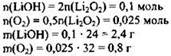
3) Определена масса раствора, и рассчитана массовая доля гидроксида лития в нём:
![]()
4) Записано уравнение реакции избытка углекислого газа со щёлочью, и найден объём углекислого газа:
![]()
34
1) Определено число атомов углерода, водорода и кислорода в соединении CxHyOz:
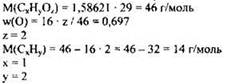
2) Определена молекулярная формула вещества: СН2O2.
3) Составлена структурная формула вещества:
![]()
4) Составлено уравнение реакции с пропанолом-2: