Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Скорость реакции, ее зависимость от различных факторов - Химическая реакция - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. В каком из сосудов равного объема реакция образования вещества протекала с наибольшей средней скоростью, если за одно и то же время в первом сосуде образовалось 10 г HF, во втором — 10 г фтора, в третьем — 57,6 г иодоводорода?
1) в первом
2) во втором
3) в третьем
4) скорости равны
2. Скорость взаимодействия раствора соляной кислоты максимальна с кусочком
1) железа
2) магния
3) цинка
4) меди
3. Укажите реакцию, которая при обычных условиях протекает с наибольшей скоростью.
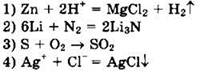
4. Скорость реакции возрастает при увеличении
1) концентрации реагентов
2) концентрации продуктов реакции
3) объема реагентов
4) объема продуктов реакции
5. Соляная кислота с максимальной скоростью реагирует с железом, которое находится в виде
1) стружки
2) слитка
3) порошка
4) пластинки
6. Увеличение температуры в большей степени увеличивает скорость реакций
1) экзотермических
2) эндотермических
3) одинаково для всех реакций
4) соединения
7. Как изменится скорость реакции ![]()
![]() при увеличении давления в три раза?
при увеличении давления в три раза?
1) увеличится в 2 раза
2) увеличится в 3 раза
3) уменьшится в 3 раза
4) не изменится
8. Катализатор увеличивает скорость
1) прямой и обратной реакций одинаково
2) только прямой реакции
3) только обратной реакции
4) прямой реакции больше, чем обратной
9. Для увеличения скорости реакции железа с хлором надо
1) понизить температуру
2) понизить давление хлора
3) измельчить железо
4) добавить ингибитор реакции
10. Скорость реакции ![]() понизится при
понизится при
1) добавлении катализатора
2) повышении температуры
3) разбавлении раствора кислоты
4) повышении давления
Тесты с выбором ответа для самостоятельного решения
11. Три реакции в сосудах равного объема протекали с такими скоростями, что за одно и то же время в первом сосуде образовалось 10,2 г сероводорода, во втором — 5,4 г воды, в третьем — 24,3 г бромоводорода. В каком из сосудов реакция образования вещества шла с наибольшей средней скоростью?
1) в первом
2) во втором
3) в третьем
4) скорости равны
12. С наибольшей скоростью при низких температурах водород реагирует с
1) фтором
2) хлором
3) бромом
4) иодом
13. С наибольшей скоростью при комнатной температуре протекает реакция
1) железа с серой
2) растворов гидроксида калия и серной кислоты
3) меди с раствором азотной кислоты
4) оксида магния с раствором соляной кислоты
14. Скорость взаимодействия гранулы цинка минимальна с раствором кислоты
1) азотной
2) соляной
3) уксусной
4) серной
15. Наиболее бурно выделяется газ при взаимодействии карбоната кальция с раствором серной кислоты, если карбонат кальция находится в виде
1) куска мела
2) порошка мела
3) мраморной фигурки
4) ракушки
16. С увеличением температуры возрастает скорость реакций
1) экзотермических
2) эндотермических
3) любых реакций
4) соединения
17. Во сколько раз увеличится скорость реакции ![]() при увеличении давления в два раза?
при увеличении давления в два раза?
1) в 4 раза
2) в 3 раза
3) в 2 раза
4) не изменится
18. Какие из приведенных утверждений верны? А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не участвует. Б. Катализатор в равной степени увеличивает скорости прямой и обратной реакций.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Для уменьшения скорости взаимодействия цинка с хлором следует
1) добавить катализатор
2) увеличить давление хлора
3) измельчить цинк
4) уменьшить температуру
20. Скорость реакции ![]() повысится при
повысится при
1) понижении давления
2) разбавлении раствора кислоты
3) повышении температуры
4) повышении давления
Ответы на тесты раздела 1.4.3
1. 1 2. 2 3. 4 4. 1 5. 3 6. 2 7. 4 8. 1 9. 3 10. 3 11. 4 12. 1 13. 2 14. 3 15. 2 16. 3 17. 1 18. 2 19. 4 20. 3
Решения тестов раздела 1.4.3
Решение 1. Скорость гомогенной химической реакции — это изменение количества вещества за единицу времени в единице объема: ![]() где v — скорость, τ — время, V — объем, Δv = v2- v1, где v2 — количество вещества продуктов реакции, a v1 — количество вещества реагентов. Скорость может измеряться в моль/(с∙л). Так как количество вещества реагентов уменьшается в ходе реакции Δv < 0, а количество вещества продуктов увеличивается в ходе реакции Δv > 0, то перед выражением скорости химической реакции ставится знак минус для реагентов и знак плюс для продуктов реакции.
где v — скорость, τ — время, V — объем, Δv = v2- v1, где v2 — количество вещества продуктов реакции, a v1 — количество вещества реагентов. Скорость может измеряться в моль/(с∙л). Так как количество вещества реагентов уменьшается в ходе реакции Δv < 0, а количество вещества продуктов увеличивается в ходе реакции Δv > 0, то перед выражением скорости химической реакции ставится знак минус для реагентов и знак плюс для продуктов реакции.
Поскольку в условии задачи указано, что объемы сосудов и время реакций были одинаковыми, то скорость реакции будет пропорциональна количеству образовавшегося вещества. Определим количество вещества образовавшихся продуктов. ![]()
![]() Видно, что наибольшее количество вещества образовалось в первом сосуде.
Видно, что наибольшее количество вещества образовалось в первом сосуде.
Ответ: 1.
Решение 2. Скорость реакции зависит от природы реагирующих веществ и условий протекания реакции (концентрации, температуры, давления газа, катализатора и т.д.). Химическая активность металлов главных подгрупп ослабевает в периодах и усиливается в группах периодической системы элементов. Химическая активность неметаллов усиливается в периодах и ослабевает в группах периодической системы элементов. В растворах химическая активность металлов характеризуется электрохимическим рядом напряжений металлов.
Согласно ряду напряжений металлов наиболее активным среди перечисленных в задании металлов является магний. Именно магний и будет с наибольшей скоростью реагировать с раствором соляной кислоты.
Ответ: 2.
Решение 3. Различают реакции гомогенные и гетерогенные. В гомогенных реакциях реагенты составляют одну фазу — жидкую или газообразную. В этом случае реакция идет во всем объеме реагентов. В гетерогенных реакциях реагенты находятся в разных фазах: твердая фаза реагирует с жидкой фазой или твердая фаза реагирует с газовой фазой. В этом случае реакция идет только на поверхности раздела двух фаз. Гомогенные реакции идут с большими скоростями, чем гетерогенные реакции.
Среди перечисленных в задании реакций первые три реакции гетерогенные, а четвертая — гомогенная. Именно эта реакция между ионами протекает с наибольшей скоростью — практически мгновенно.
Ответ: 4.
Решение 4. Увеличение концентраций реагирующих веществ приводит к увеличению числа столкновений между молекулами и к увеличению скорости химической реакции. Поэтому увеличение концентраций реагентов приводит к увеличению скорости данной реакции. Увеличение концентраций продуктов реакции не влияет на скорость данной прямой реакции, но приводит к увеличению скорости обратной реакции. Поскольку скорость реакции определяется как изменение количества вещества за единицу времени в единице объема, то изменение объема системы при неизменности других параметров не меняет скорость реакции. Если же при увеличении объема, например при разбавлении раствора, концентрации реагентов или продуктов уменьшились, то это приводит к уменьшению скорости прямой или обратной реакции соответственно.
Ответ: 1.
Решение 5. Скорость реакции не зависит от концентрации твердых веществ, которая остается постоянной, а зависит от площади поверхности твердых веществ. При уменьшении размеров частиц твердого вещества площадь поверхности твердого вещества увеличивается, что и приводит к увеличению скорости реакции этого твердого вещества с жидкостью или газом. Поэтому с соляной кислотой с наибольшей скоростью будет реагировать железо в виде порошка.
Ответ: 3.
Решение 6. При увеличении температуры возрастают скорости любых химических реакций. Правило Вант-Гоффа: при увеличении температуры на 10° скорость реакции увеличивается в 2-4 раза. Время протекания химической реакции обратно пропорционально скорости реакции. Повышение температуры увеличивает скорость эндотермических реакций в большей степени, чем скорость экзотермических реакций. Именно поэтому при повышении температуры равновесие сдвигается в сторону эндотермических реакций. Реакции соединения, как правило, являются экзотермическими реакциями.
Ответ: 2.
Решение 7. Изменение давления влияет на скорость реакции с участием газообразных реагентов, при этом повышение давления в системе приводит к увеличению концентрации реагентов и соответственно к увеличению скорости реакции между ними. Концентрации твердых и жидких реагентов при изменении давления не меняются, поэтому и скорости реакций между жидкими и твердыми реагентами при изменении давления не меняются. Поэтому скорость указанной в задании реакции при увеличении давления не изменится.
Ответ: 4.
Решение 8. Катализаторы — вещества, изменяющие скорость химической реакции и остающиеся неизменными после реакции. Принимая участие в реакции, катализаторы изменяют механизм реакции, уменьшая энергию активации, что и приводит к увеличению скорости реакции. Энергия активации — это энергия, которую нужно сообщить молекулам реагирующих веществ для осуществления реакции между ними. Не каждое столкновение двух молекул приводит к реакции. Реакция происходит, если эти молекулы имеют энергию большую, чем энергия активации для данной реакции. В случае равновесия катализаторы одинаково увеличивают скорости прямой и обратной реакций, не сдвигая равновесия.
Ответ: 2.
Решение 9. Реакция железа с хлором — это реакция твердого вещества с газом: ![]() При понижении температуры скорость этой реакции, как и любой другой реакции, уменьшается. При понижении давления хлора его концентрация уменьшается и скорость реакции также уменьшается. При измельчении железа площадь поверхности железа увеличивается и скорость реакции также увеличивается. Ингибиторы реакции — это вещества, подобные катализаторам, но действующие противоположно им. Ингибиторы меняют механизм реакции, увеличивают энергию активации и уменьшают скорость реакции. Добавление ингибиторов реакции уменьшает скорость реакции.
При понижении температуры скорость этой реакции, как и любой другой реакции, уменьшается. При понижении давления хлора его концентрация уменьшается и скорость реакции также уменьшается. При измельчении железа площадь поверхности железа увеличивается и скорость реакции также увеличивается. Ингибиторы реакции — это вещества, подобные катализаторам, но действующие противоположно им. Ингибиторы меняют механизм реакции, увеличивают энергию активации и уменьшают скорость реакции. Добавление ингибиторов реакции уменьшает скорость реакции.
Ответ: 3.
Решение 10. Реакция цинка с соляной кислотой — это реакция твердого вещества с раствором. Добавление катализатора и повышение температуры приводят к увеличению скорости реакции. Разбавление раствора соляной кислоты уменьшает концентрацию кислоты и уменьшает скорость реакции. Повышение давления в системе не меняет скорость реакции, поскольку среди реагентов нет газообразных веществ.
Ответ: 3.