Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов - Химическая реакция - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с кратким ответом с решениями
1. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении температуры в системе.
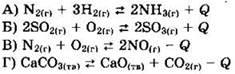
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
2. Установите соответствие между уравнением реакции и направлением смещения равновесия при уменьшении температуры в системе.
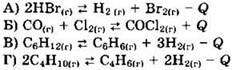
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
3. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении температуры в системе.
![]()
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
4. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении давления в системе.
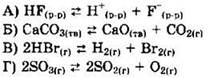
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
5. Установите соответствие между уравнением реакции и направлением смещения равновесия при уменьшении давления в системе.
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
6. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении концентрации водорода в системе.
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
7. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
А) увеличение концентрации СO2
Б) уменьшение температуры
В) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
8. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) увеличение концентрации О2
Б) уменьшение температуры
B) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
9. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) увеличение концентрации Н2
Б) уменьшение температуры
B) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
10. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) уменьшение концентрации Н2
Б) увеличение температуры
B) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
Тесты с кратким ответом для самостоятельного решения
11. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении температуры в системе.
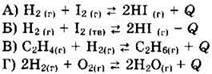
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
12. Установите соответствие между уравнением реакции и направлением смещения равновесия при уменьшении температуры в системе.
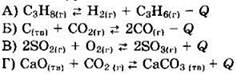
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
13. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении температуры в системе.
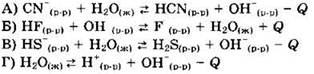
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
14. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении давления в системе.
![]()
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
15. Установите соответствие между уравнением реакции и направлением смещения равновесия при уменьшении давления в системе.
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
16. Установите соответствие между уравнением реакции и направлением смещения равновесия при увеличении концентрации кислорода в системе.
![]()
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
17. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) уменьшение концентрации NH3
Б) увеличение температуры
B) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
18. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
А) уменьшение концентрации Н2
Б) увеличение температуры
В) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
19. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) уменьшение концентрации СO2
Б) уменьшение температуры
B) уменьшение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
20. Для реакции ![]() установите соответствие между изменением параметра и направлением смещения химического равновесия.
установите соответствие между изменением параметра и направлением смещения химического равновесия.
A) увеличение концентрации O2
Б) увеличение температуры
B) увеличение давления
Г) введение катализатора
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) равновесие не смещается
Ответы на тесты раздела 1.4.4.
1. 2211 2. 2122 3. 2121 4. 3232 5. 2132 6. 1212 7. 2113 8. 1233 9. 1113 10. 1123 11. 2122 12. 2211 13. 1211 14. 2311 15. 2123 16. 2121 17. 2123 18. 2133 19. 2213 20. 1213
Решения тестов раздела 1.4.4.
Решение 1. Правило Ле Шателье (принцип противодействия): если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию. В ходе экзотермических реакций, для которых Q > 0, происходит выделение теплоты, и температура системы повышается. В ходе эндотермических реакций, для которых Q < 0, происходит поглощение теплоты, и температура системы понижается. Если мы повышаем температуру, то, согласно правилу Ле Шателье, система стремится понизить температуру, для чего и происходит сдвиг химического равновесия в сторону эндотермической реакции. Аналогично, при понижении температуры равновесие сдвигается в сторону экзотермической реакции.
Первые две реакции - экзотермические (Q > 0), а обратные им реакции - эндотермические. Повышение температуры сдвигает равновесие в сторону эндотермических обратных реакций, то есть в сторону исходных веществ.
Вторые две реакции - эндотермические (Q < 0), а обратные им реакции - экзотермические. Повышение температуры сдвигает равновесие в сторону эндотермических прямых реакций, то есть в сторону продуктов реакции.
Ответ: 2211.
Решение 2. Согласно правилу Ле Шателье, при понижении температуры равновесие сдвигается в сторону экзотермической реакции. Знак теплового эффекта реакции указывает на экзотермический (Q > 0) или эндотермический (Q < 0) характер реакции.
Так, первая, третья и четвертая реакция являются эндотермическими, а обратные им реакции - эндотермическими. Поэтому равновесие в этих реакциях будет смещаться в сторону исходных веществ. Вторая реакция - экзотермическая, и при понижении температуры равновесие будет смещаться в сторону продуктов реакции.
Ответ: 2122.
Решение 3. Знак теплового эффекта может быть и не указан для ряда реакций. Следует помнить, что, как правило, реакции соединения являются экзотермическими, а реакции разложения - эндотермическими. Реакция горения - экзотермическая, но реакция азота с кислородом с образованием NO является эндотермической. Реакции нейтрализации - экзотермические, а реакции гидролиза солей - эндотермические. Реакция иода с водородом при низких температурах, когда иод является твердым веществом, — это эндотермическая реакция. Однако при высоких температурах, когда иод становится газообразным веществом, эта реакция становится экзотермической.
Согласно правилу Ле Шателье, при повышении температуры равновесие сдвигается в сторону эндотермической реакции.
Ответ: 2121.
Решение 4. Универсальный газовый закон (pV = vRT) показывает, что давление (р) в системе определяется количеством вещества (v) газообразных соединений. Если в ходе реакции количество вещества газов возрастает, то давление в системе повышается. Если в ходе реакции количество вещества газов уменьшается, то давление в системе понижается. Используем правило смещения равновесия - правило противодействия. Если мы повышаем давление в системе, то система стремится понизить давление, для чего равновесие реакции сдвигается в сторону меньшего количества вещества газов или меньшего числа газообразных молекул. Аналогично при понижении давления равновесие сдвигается в сторону большего количества вещества газов или большего числа газообразных молекул.
В первом уравнении задания нет ни газообразных реагентов, ни газообразных продуктов, поэтому при повышении давления равновесие не смещается. Во втором уравнении нет газообразных реагентов и имеется 1 моль газообразных продуктов, поэтому при повышении давления равновесие в системе смещается в сторону исходных веществ. В третьем уравнении задания имеется 2 моль газообразных реагентов и 2 моль газообразных продуктов, поэтому при повышении давления равновесие не сдвигается. В четвертом уравнении, имеется 2 моль газообразных реагентов и 3 моль газообразных продуктов, поэтому при повышении давления равновесие будет сдвигаться в сторону исходных веществ.
Ответ: 3232.
Решение 5. Согласно правилу смещения равновесия при понижении давления равновесие сдвигается в сторону большего количества вещества газов или большего числа газообразных молекул.
В первом уравнении реакции имеется 4 моль газообразных реагентов и 2 моль газообразных продуктов, поэтому равновесие смещается в сторону исходных веществ. Во втором уравнении реакции имеется 2 моль газообразных реагентов и 3 моль газообразных продуктов, поэтому равновесие смещается в сторону продуктов реакции. В третьем уравнении реакции имеется 2 моль газообразных реагентов и 2 моль газообразных продуктов, поэтому равновесие не смещается. В четвертом уравнении реакции имеется 3 моль газообразных реагентов и 2 моль газообразных продуктов, поэтому равновесие смещается в сторону исходных веществ.
Ответ: 2132.
Решение 6. Для системы ![]() в ходе прямой реакции концентрации реагентов А и В уменьшаются, а концентрации продуктов реакции С и D увеличиваются. В ходе обратной реакции концентрации веществ С и D уменьшаются, а концентрации веществ А и В увеличиваются. Используем правило смещения равновесия - правило противодействия.
в ходе прямой реакции концентрации реагентов А и В уменьшаются, а концентрации продуктов реакции С и D увеличиваются. В ходе обратной реакции концентрации веществ С и D уменьшаются, а концентрации веществ А и В увеличиваются. Используем правило смещения равновесия - правило противодействия.
Увеличение концентрации вещества сдвигает равновесие в сторону реакции, которая уменьшает количество этого вещества. Уменьшение концентрации вещества сдвигает равновесие в сторону реакции, которая увеличивает количество этого вещества.
В первом и третьем уравнениях реакции водород находится среди исходных веществ, поэтому увеличение концентрации водорода будет способствовать смещению равновесия в сторону реакции, в ходе которой концентрация водорода уменьшается, то есть в сторону прямой реакции (в сторону продуктов реакции). Во втором и четвертом уравнениях водород находится среди продуктов, поэтому увеличение концентрации водорода будет способствовать смещению равновесия в сторону реакции, в ходе которой концентрация водорода уменьшается, то есть в сторону обратной реакции (в сторону исходных веществ).
Ответ: 1212.
Решение 7. Увеличение концентрации продукта реакции СO2 сдвигает равновесие в сторону обратной реакции. Уменьшение температуры сдвигает равновесие в сторону экзотермической реакции, то есть в сторону прямой реакции. Увеличение давления сдвигает равновесие в сторону меньшего числа газообразных молекул. Поскольку имеется 3 моль газообразных реагентов и 2 моль газообразных продуктов, то равновесие смещается в сторону прямой реакции.
В состоянии равновесия скорость прямой реакции равна скорости обратной реакции. Добавление катализатора увеличивает скорости прямой и обратной реакций в равной степени, поэтому равновесие в системе не сдвигается.
Ответ: 2113.
Решение 8. Увеличение концентрации реагента 02 сдвигает равновесие в сторону прямой реакции. Уменьшение температуры сдвигает равновесие в сторону экзотермической реакции, то есть в сторону обратной реакции. Увеличение давления не сдвигает равновесие реакции, поскольку имеется одинаковое количество газообразных реагентов (2 моль) и продуктов реакции (2 моль). Добавление катализатора не сдвигает равновесие реакции.
Ответ: 1233.
Решение 9. Увеличение концентрации реагента Н2 сдвигает равновесие в сторону прямой реакции. Уменьшение температуры сдвигает равновесие в сторону экзотермической реакции, то есть в сторону прямой реакции. Увеличение давления сдвигает равновесие в сторону меньшего числа газообразных молекул. Поскольку имеется 2 моль газообразных реагентов и 1 моль газообразных продуктов, то равновесие смещается в сторону прямой реакции. Добавление катализатора не сдвигает равновесие реакции.
Ответ: 1113.
Решение 10. Уменьшение концентрации реагента Н2 сдвигает равновесие в сторону обратной реакции. Увеличение температуры сдвигает равновесие в сторону эндотермической реакции, то есть в сторону прямой реакции. Поскольку имеется 1 моль газообразных реагентов и 2 моль газообразных продуктов, то увеличение давления сдвигает равновесие в сторону обратной реакции. Добавление катализатора не сдвигает равновесие реакции.
Ответ: 2123.