Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) - Расчеты по химическим формулам и уравнениям реакций - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Тесты с полным ответом с решениями
1. Сколько граммов соли образуется при реакции 0,5 моль гидроксида калия с 49 г серной кислоты?
2. Сколько граммов соли образуется при взаимодействии 18,67 г гидроксида калия и 14,08 г серной кислоты?
3. Определите массу осадка, образующегося при пропускании 560 мл (н.у.) СО2 через 40 г раствора гидроксида бария с массовой долей 0,12.
4. Рассчитайте массовую долю соли в растворе, образовавшемся при действии 25 мл 20%-ной соляной кислоты (ρ = 1,1 г/мл) на 4,0 г сульфида железа.
5. К 300 г 12%-ного раствора сульфата меди прибавили 200 г 16%-ного раствора сульфида натрия. Определите массовые доли солей в образовавшемся растворе.
6. Сколько граммов соли образуется при пропускании 22,4 л оксида серы(IV) в раствор, содержащий 1 моль гидроксида натрия?
7. Определите объем водорода (н.у.), выделившегося при обработке раствором гидроксида натрия смеси, полученной при сплавлении 6 г магния и 45 г оксида кремния(IV).
8. В 49 г 2%-ного раствора фосфорной кислоты растворили 0,80 г NaOH. Вычислите массовую долю образовавшегося вещества в растворе.
9. Раствор, содержащий 13 г нитрата серебра, смешали с 41,7 мл 26%-ного раствора хлорида натрия (ρ = 1,2 г/мл) и осадок отфильтровали. Рассчитайте массу каждого из оставшихся в растворе веществ.
10. Смешали 300 г 15%-ного раствора фосфорной кислоты и 200 г 10%-ного раствора гидроксида калия. Определите массовую долю веществ в образовавшемся растворе.
Ответы на тесты раздела 4.3.5
1. 68 г 2. 25г 3. 4,92 г 4. 0,193 5. w(Na2S) = 0,0302, w(Na2SO4) = 0,0668 6. 104 г 7. 5,6 л 8. 0,0285 9. 8,54 г NaCl и 6,49 г NaNO3 10. w(Н3РО4) = 0,0200 и w(KH2PO4) = 0,0971.
Решения тестов раздела 4.3.5
Решение 1. В зависимости от соотношения между количествами вещества реагентов могут идти две реакции:
![]()
Находим ![]()
Так как v(KOH) = v(H2SO4) = 0,5 моль, то реакция идет по уравнению (1), при этом вещества полностью вступают в реакцию.
По уравнению (1) находим v(KHSO4) = 0,5 моль.
Отсюда ![]()
Ответ: 68 г.
Решение 2. Находим количество вещества реагентов: ![]()
![]() Видно, что v(KOH) : v(H2SO4.) = 0,3334 : 0,1437 = 2,32 : 1. При подобном соотношении между количествами вещества реагентов реакция будет идти по второму из уравнений реакции, написанных в решении предыдущего задания. Записываем уравнение реакции в виде
Видно, что v(KOH) : v(H2SO4.) = 0,3334 : 0,1437 = 2,32 : 1. При подобном соотношении между количествами вещества реагентов реакция будет идти по второму из уравнений реакции, написанных в решении предыдущего задания. Записываем уравнение реакции в виде
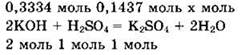
КОН — в избытке, так как для реакции с серной кислотой нужно 0,2874 моль КОН, а имеется 0,3334 моль КОН. Количество вещества сульфата калия находим по веществу в недостатке, то есть по серной кислоте: v(K2SO4) = v(H2SO4) = 0,1437 моль.
Находим массу соли: ![]()
Ответ: 25 г.
Решение 3. В зависимости от соотношения между количествами вещества реагентов могут идти две реакции:
![]()
Находим количества вещества реагентов:
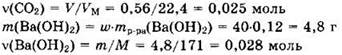
При таком соотношении реагентов (v(Ba(OH)2) > v(CO2)) образуется только средняя соль и реакция идет по уравнению (1). Запишем уравнение реакции в виде:
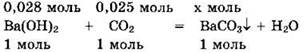
Видно, что Ва(ОН)2 — в избытке, а v(BaCO3) = v(CO2) = 0,025 моль.
Находим массу осадка: ![]()
Ответ: 4,92 г.
Решение 4. Находим: ![]()
![]()
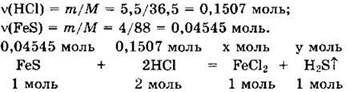
Видно, что НСl — в избытке,

Ответ: 0,193.
Решение 5. Находим массы и количества вещества исходных реагентов:
![]()
![]()
Запишем уравнение реакции виде:
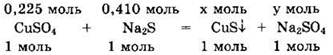
Видно, что для реакции с 0,225 моль CuSO4 надо 0,225 моль Na2S, а имеется 0,410 моль Na2S. Значит, сульфид натрия — в избытке, а сульфат меди — в недостатке. Поскольку сульфид меди(II) нерастворим, то в образовавшемся растворе находятся две соли: избыток сульфида натрия и образовавшийся сульфат натрия. Находим оставшееся количество вещества и массу Na2S: v(Na2S) = 0,410 - 0,225 = 0,185 моль, m(Na2S) = v ∙ M = 0,185 ∙ 78 = 14,43 г.
По уравнению реакции находим х = v(CuS) = 0,225 моль, v(Na2SO4) = 0,225 моль.
Отсюда ![]()
![]()
Находим массу образовавшегося раствора:
![]()
Находим массовые доли солей в растворе:
![]()
Ответ: w(Na2S) = 0,0302, w(Na2SO4) = 0,0668.
Решение 6. В зависимости от соотношения между количествами реагирующих веществ могут идти две реакции:
![]()
Находим v(SO2) = V/VM = 1 моль. Поскольку v(SO2) = v(NaOH) = 1 моль, идет реакция (1) и образуется 1 моль NaHSO3.
Отсюда ![]()
Ответ: 104 г.
Решение 7. Находим количества вещества исходных реагентов:
![]()
Запишем уравнение реакции в виде
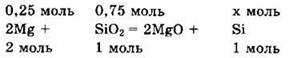
Так как магний в недостатке, то образования силицида магния не происходит.
Находим ![]()
Записываем уравнение реакции кремния с щелочью в виде:
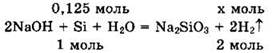
Из уравнения находим ![]() a
a ![]()
Ответ: 5,6 л.
Решение 8. Находим количества вещества исходных реагентов:

Имеем v(NaOH) : v(H3PO4) = 2 : 1.
При подобном соотношении между количествами реагентов образуется гидрофосфат натрия и реакция идет в соответствии с уравнением:
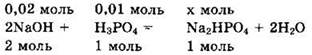
Исходные вещества реагируют полностью, и образуется 0,01 моль Na2HPO4.
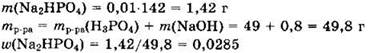
Ответ: 0,0285.
Решение 9. Находим количества вещества исходных реагентов:
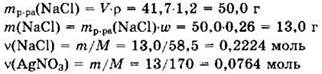
Запишем уравнение реакции в виде:
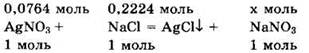
Видно, что NaCl — в избытке, a AgCl выпадает в осадок. После реакции в растворе останутся избыток хлорида натрия и образовавшийся нитрат натрия.

Ответ: 8,54 г NaCl и 6,49 г NaNO3.
Решение 10. Находим массы и количества вещества исходных реагентов:
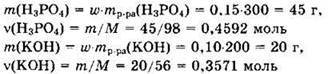
Поскольку v(KOH) < v(H3PO4), то в ходе реакции образуется дигидрофосфат калия:
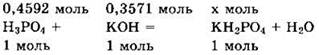
Для реакции с 0,3571 моль гидроксида калия надо 0,3571 моль фосфорной кислоты, а имеется 0,4592 моль, то есть больше, чем нужно. Находим количества вещества и массу избытка фосфорной кислоты, оставшегося в растворе:
![]()
Из уравнения реакции находим: v(KH2PO4) = 0,3571 моль.
Отсюда ![]()
Находим массу образовавшегося раствора:
![]()
Находим массовые доли веществ в растворе:
![]()
Ответ: w(H3PO4) = 0,0200 и w(KH2PO4) = 0,0971.