Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества - Расчеты по химическим формулам и уравнениям реакций - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Тесты с полным ответом с решениями
1. В 800 г 9%-ного раствора фосфорной кислоты растворили при нагревании 71 г оксида фосфора(V). Определите массовую долю фосфорной кислоты в полученном растворе.
2. К 145,2 мл 18%-ного раствора серной кислоты с плотностью 1,125 г/мл прибавили 205,5 мл 10%-ного раствора гидроксида калия с плотностью 1,09 г/мл. Определите объем 6%-ного раствора гидроксида натрия с плотностью 1,065 г/мл, необходимый для полной нейтрализации полученной смеси.
3. Натрий массой 11,5 г растворили в 200 г 10%-ного раствора гидроксида натрия. Определите массовую долю полученного раствора.
4. Смешали 192 мл 14%-ного раствора серной кислоты с плотностью 1,095 г/мл и 129,6 мл 18%-ного раствора гидроксида натрия с плотностью 1,20 г/мл. Определите объем воды, который надо добавить к полученному раствору, чтобы массовая доля соли в нем составила 8%.
5. К 400 мл 35% -ной соляной кислоты с плотностью 1,17 г/мл добавили 31,6 г перманганата калия. Определите массовую долю каждой соли в полученном растворе.
6. В 122,5 г 40%-ного раствора серной кислоты растворили 60 г оксида серы(VI). Определите массовую долю серной кислоты в полученном растворе.
7. К 165,2 мл 8,5%-ного раствора соляной кислоты с плотностью 1,04 г/мл прибавили 141,2 мл 20%-ного раствора гидроксида калия с плотностью 1,19 г/мл. Определите объем 6%-ного раствора серной кислоты с плотностью 1,04 г/мл, необходимый для полной нейтрализации полученной смеси.
8. Определите массу оксида натрия, которую необходимо растворить в 150 г 10%-ного раствора гидроксида натрия для получения 20%-ного раствора.
9. К 162,1 мл 11%-ного раствора азотной кислоты с плотностью 1,06 г/мл добавили 19,2 г карбида кальция. Определите объем 28%-ной соляной кислоты с плотностью 1,14 г/мл, который следует добавить к полученной смеси для ее полной нейтрализации.
10. Определите массу карбида алюминия, который следует добавить к 250 г 16%-ного раствора соляной кислоты, чтобы массовая доля кислоты уменьшилась в два раза.
Ответы на тесты раздела 4.3.6
1. 0,195 2. 125 мл 3. 0,190 4. 167 мл 5. w(МnСl2) = 0,0543, w(КСl) = 0,0321 6. 0,671 7. 157 мл 8. 13,8 г 9. 34,3 мл 10. 6,41 г
Решения тестов раздела 4.3.6
Решение 1. В исходном растворе: m1(Н3РО4) = 800 ∙ 0,09 = 72 г. Для оксида фосфора(V) находим v(P2O5) = 71/142 = 0,5 моль. Оксид фосфора(V) при нагревании реагирует с водой с образованием ортофосфорной кислоты: P2O5 + 3Н2O = 2Н3РO4.
Из уравнения видно, что v(H3PO4) = 2 ∙ v(P2O5) = 1,0 моль, при этом m2(Н3РO4) = 1 ∙ 98 = 98 г.
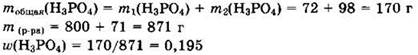
Ответ: 0,195.
Решение 2. Находим количества вещества исходных веществ:
![]()
Запишем уравнения полной нейтрализации:
![]()
Из уравнения (1) следует, что с 0,4 моль КОН прореагирует 0,2 моль H2SO4, а в избытке останется v(H2SO4) = 0,3 - 0,2 = 0,1 моль.
Из уравнения (2) следует, что с 0,1 моль H2SO4 будут реагировать 0,2 моль NaOH.
Находим ![]()
![]()
Ответ: 125 мл.
Решение 3. Находим ![]()
![]()
Записываем уравнение:
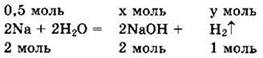
Из уравнения следует, что
![]()
Откуда ![]() и
и
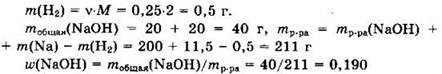
Ответ: 0,190.
Решение 4. Выполняем расчеты для исходных веществ.
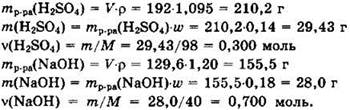
Ha 0,3 моль H2SO4 приходится 0,7 моль NaOH, то есть на 1 моль H2SO4 приходится более 2 моль NaOH. Поэтому реакция идет с образованием средней соли.
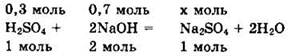
Из уравнения видно, что NaOH — в избытке, а ![]()
Отсюда ![]()
![]()
Пусть к этому раствору добавили х г воды, тогда mр-ра = (365,7 + х) г, а масса вещества останется прежней m(Na2SO4) = 42,6 г. Для этого раствора w = 0,08. Отсюда имеем:

Поскольку плотность воды равна 1 г/мл, находим ![]()
Ответ: 167 мл.
Решение 5. Находим массу исходного раствора соляной кислоты: ![]()
Находим массу и количество вещества хлороводорода:
![]()
Находим количество вещества перманганата калия:
![]()
Записываем уравнение реакции в виде
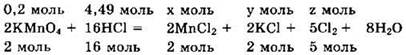
Для реакции с перманганатом калия нужно v(HCl) = 0,2 ∙ 16/2 = 1,60 моль, а имеется 4,49 моль. То есть соляная кислота в избытке, а перманганат калия реагирует полностью. Из уравнения реакции находим ![]()
![]()
![]()
Отсюда ![]()
![]()
Находим массу образовавшегося раствора ![]()
![]()
Находим ![]()
![]()
Ответ: w(МnСl2) = 0,0543, w(КСl) = 0,0321.
Решение 6. В исходном растворе m1(H2SO4) = 122,5 ∙ 0,4 = 49 г.
![]()
Оксид серы взаимодействует с водой с образованием серной кислоты:
SO3 + Н2O = H2SO4
Из уравнения видно, что v(H2SO4) = v(SO3) = 0,75 моль.
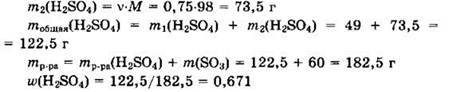
Ответ: 0,671.
Решение 7. Находим количества вещества исходных веществ:

Из уравнения (1) следует, что с 0,4 моль НСl прореагирует 0,4 моль КОН, а в избытке останется 0,2 моль КОН.
Из уравнения (1) следует, что с оставшимися 0,2 моль КОН прореагирует 0,1 моль H2SO4.
Находим ![]()
![]()
Ответ: 157 мл.
Решение 8. Находим ![]()
![]()
Пусть v(Na2O) = х моль. Тогда m(Na2O) = M ∙ v = 62х г. Запишем уравнение реакции в виде:
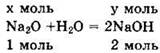
Из уравнения видно: у = v(NaOH) = 2v(Na2O) = 2х моль. Отсюда m2(NaOH) = M ∙ v = 40 ∙ 2х = 80х г.
Для полученного раствора с w = 0,2 имеем:
![]()
Откуда имеем: 30 + 12,4х = 15 + 80х; 67,6х = 15; х = v(Na2O) = 0,222 моль.
Отсюда m(Na2O) = M ∙ v = 62 ∙ 0,222 = 13,8 г.
Ответ: 13,8 г.
Решение 9. Находим количества вещества исходных веществ:
![]()
Одна часть карбида кальция реагирует с азотной кислотой другая часть — с водой.
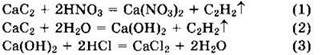
Из уравнения (1) видно, что с 0,3 моль HNO3 прореагирует 0,15 моль СаС2.
Оставшиеся 0,15 моль СаС2 реагируют с водой по уравнению (2), при этом образуется 0,15 моль Са(ОН)2. Это количество Са(ОН)2 реагирует с соляной кислотой по уравнению (3). При этом v(HCl) = 2v(CaC2) = 0,3 моль. Отсюда
![]()
![]()
Ответ: 34,3 мл.
Решение 10. Находим массу и количество вещества хлороводорода.
![]()
Пусть V(AL4C3) = х моль и ![]() Запишем уравнение в виде:
Запишем уравнение в виде:
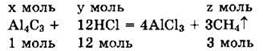
Видно, что у = v2(HCl) = 12х моль, а z = v(CH4) = 3х моль.
Отсюда ![]() и
и ![]()
Для полученного раствора имеем: ![]()
![]()
По условию ![]()
![]() Отсюда
Отсюда
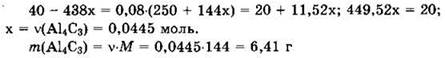
Ответ: 6,41 г.