Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного - Расчеты по химическим формулам и уравнениям реакций - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Выход продукта реакции η — это отношение практически полученной массы (количества вещества, объема) продукта к теоретической (рассчитанной по уравнению реакции) массе (количеству вещества, объему) этого продукта:
![]()
Задания с полным ответом с решениями
1. Сколько граммов оксида серы(IV) образуется при сжигании 10 г технической серы, содержащей 96% чистой серы, если выход реакции составляет 90%?
2. Карбонат кальция массой 48 г, содержащий в качестве примеси 4% сульфата кальция, обработали избытком раствора соляной кислоты. Определите объем полученного газа, если выход реакции составил 95%.
3. Определите объем сернистого газа в литрах (н.у.), образовавшегося при обжиге 180 г пирита, содержащего 92% FeS2, если выход реакции составил 93,8%. Ответ запишите в виде целого числа без указания единиц измерения.
4. Сколько граммов карбоната кальция необходимо подвергнуть термическому разложению, чтобы выделившийся углекислый газ образовал с избытком гидроксида бария осадок массой 9,85 г, если выход реакции разложения карбоната кальция равен 90%, а выход реакции взаимодействия углекислого газа с гидроксидом бария равен 95%?
5. Пронитровали 60 г ароматического углеводорода. Образовавшееся единственное мононитропроизводное восстановили железом в кислой среде и получили с выходом 76,7% вещество, которое полностью поглощает газ, выделяющийся при действии избытка концентрированной серной кислоты на 29,25 г хлорида натрия. Определите исходный углеводород.
6. Определите массу простого эфира, которая получится из 100 г этанола, если реакция дегидратации протекает с выходом 85%.
7. Технический цинк массой 124 г, содержащий в качестве примеси 2% оксида цинка, обработали избытком раствора соляной кислоты. Определите объем полученного газа, если выход реакции составил 93,1%.
8. Определите массовую долю примесей в угле, если при сгорании 42 г угля было получено с выходом 85% 60 л (н.у.) углекислого газа.
9. Определите массу бензола, который можно получить из ацетилена, полученного при взаимодействии 19,2 г карбида кальция с избытком воды, если выход ацетилена составляет 83,3%, а выход бензола — 84,6%.
10. Массовая доля целлюлозы в древесине равна 50%. Какая масса раствора спирта, содержащего 10% воды, может быть получена при гидролизе 100 кг древесных опилок и брожения полученной глюкозы, если выход этанола в процессе брожения равен 75%?
Ответы на задания раздела 4.3.8
1. 17,3 г 2. 9,8 л 3. 58 л 4. 5,84 г 5. С7Н8 6. 68,4 г 7. 39 л 8. 0,10 9. 5,5 г 10. 23,7 кг
Решения заданий раздела 4.3.8
Решение 1. Предварительно определим массу чистой серы в 10 г технической серы: ![]()
Определим количество вещества серы: ![]()
Из уравнения S + О2 = SO2 видно, что v(SO2) = v(S) = 0,3 моль.
Отсюда m(SO2) = v ∙ M = 0,3 ∙ 64 = 19,2 г. Имея mтеор. = 19,2 г, η = 0,9 и формулу ![]() находим:
находим: ![]()
![]()
Ответ: 17,3 г.
Решение 2. Поскольку смесь состоит из СаСО3 и CaSО4, то
![]()
Отсюда v(CaCО3) = m/М = 46,1/100 = 0,461 моль.
Записываем уравнение реакции:
![]()
Видно, что vтеор.(CO2) = v(CaCO3) = 0,461 моль.
С учетом выхода углекислого газа находим ![]()
![]() Отсюда
Отсюда ![]()
![]()
Ответ: 9,8 л.
Решение 3. Находим массу и количество вещества FeS2 в пирите:
![]()
Запишем уравнение реакции:
![]()
Из уравнения реакции находим:
![]()
Из формулы η = vnpакт/vтеор находим:
![]()
Находим объем газа: ![]()
Ответ: 58 л.
Решение 4. Записываем уравнения реакций:
![]()
Находим количество вещества осадка — карбоната бария:
![]()
Находим ![]()
![]()
Из уравнения (2) видно, что для получения одного моля ВаСО3 надо взять один моль СО2, значит, для получения 0,0526 моль ВаСО3 надо практически взять 0,0526 моль СО2.
Таким образом, при разложении СаСО3 надо практически получить vnpaкт(CО2) = 0,0526 моль.
Отсюда ![]()
![]()
Из уравнения (1) видно, что для получения 0,0584 моль СО2 надо иметь такое же количество вещества СаСО3, то есть v(CaCО3) = 0,0584 моль.
Отсюда масса необходимого карбоната кальция равна: ![]()
Ответ: 5,84 г.
Решение 5. Общая формула гомолога бензола: СnН2n-6.
![]()
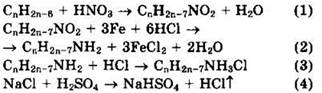
Из уравнений реакций (4) и (3) видно, что ![]()
Поскольку реакция по уравнению (2) шла не количественно, а с определенным выходом η, находим
![]()
Из уравнений реакций (2) и (1) видно, что ![]() Отсюда
Отсюда ![]()
![]() Формула углеводорода — С7Н8. Углеводород — толуол.
Формула углеводорода — С7Н8. Углеводород — толуол.
Ответ: С7Н8.
Решение 6. Находим: ![]()
![]()
По уравнению реакции находим количество вещества эфира:
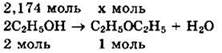
Видно, что ![]()
Находим теоретическую массу эфира: ![]()
Практически получено ![]()
Ответ: 68,4 г.
Решение 7. Поскольку технический цинк — это смесь цинка и оксида цинка, то
![]()
Отсюда v(Zn) = m/М = 121,5/65 = 1,87 моль.
Записываем уравнение реакции:
![]()
Видно, что vтeор(H2) = v(Zn) = 1,87 моль.
С учетом выхода водорода находим ![]()
![]()
Отсюда ![]()
Ответ: 39 л.
Решение 8. Определим теоретически возможный объем и количество вещества углекислого газа. Из формулы ![]() находим:
находим: ![]()
Отсюда ![]()
Запишем уравнение реакции: С + О2 = СО2.
Из уравнения реакции находим v(C) = v(CО2) = 3,15 моль.
Отсюда ![]()
Находим массу примесей и массовую долю примесей в угле:
![]()
Ответ: 0,10.
Решение 9. Записываем уравнения реакций:
![]()
Находим v(CaC2) = m/М = 19,2/64 = 0,30 моль.
Из уравнения (1) видно, что ![]()
С учетом выхода ацетилена находим ![]()
Из уравнения (2) видно, что ![]()
С учетом выхода бензола находим ![]() Отсюда
Отсюда ![]()
Ответ: 5,5 г.
Решение 10. Находим массу целлюлозы в древесине: ![]() При этом
При этом ![]()
![]()
Записываем уравнения реакций:
![]()
Из уравнения (1) видно, что ![]()
![]()
Из уравнения (2) видно, что ![]()
![]()
С учетом выхода этанола находим ![]()
![]()
Отсюда ![]() а
а ![]()
Ответ: 23,7 кг.