Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Нахождение молекулярной формулы вещества - Расчеты по химическим формулам и уравнениям реакций - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Тесты с полным ответом с решениями
1. Массовая доля водорода в кетоне равна 0,1163. При окислении этого кетона в жестких условиях образуются две кислоты. На основании этих данных:
1) произведите необходимые вычисления,
2) установите простейшую формулу кетона,
3) напишите молекулярную формулу кетона,
4) напишите уравнение реакции этого кетона с водородом на никелевом катализаторе.
2. Натриевая соль аминокислоты содержит 18,4% металла. Кислота является а-аминокислотой. На основании этих данных:
1) произведите необходимые вычисления,
2) установите простейшую формулу соли,
3) напишите молекулярную формулу а-аминокислоты,
4) напишите уравнение реакции взаимодействия этой кислоты с этанолом.
3. Метиловый эфир предельной монокарбоновой кислоты содержит 36,36% кислорода.
1) произведите необходимые вычисления,
2) установите простейшую формулу эфира,
3) определите молекулярную формулу эфира,
4) напишите уравнение реакции гидролиза этого эфира в присутствии раствора гидроксида натрия.
4. При сгорании 46,8 г углеводорода образовались 32,4 г воды и оксид углерода(IV).
1) произведите необходимые вычисления,
2) напишите уравнение реакции сгорания углеводорода в общем виде,
3) определите количество вещества атомов углерода и водорода в углеводороде,
4) определите объем израсходованного кислорода (н.у.).
5. При сжигании 1,20 г органического соединения образовались 2,16 г воды и углекислый газ, при пропускании которого в раствор гидроксида бария образовалось 15,75 г осадка. Относительная плотность паров органического соединения по аммиаку равна 1,765. На основании этих данных:
1) произведите необходимые вычисления,
2) установите простейшую формулу соединения,
3) определите истинную формулу соединения,
4) напишите уравнение реакции горения этого соединения.
6. Алкен присоединил количественно 24,3 г бромоводорода. При нагревании полученного продукта с водным раствором гидроксида калия получено 18 г спирта. На основании этих данных:
1) произведите необходимые вычисления,
2) установите молекулярную формулу исходного алкена,
3) напишите уравнение реакции данного алкена с бромоводородом,
4) назовите полученный во второй реакции спирт.
7. При сплавлении 19,2 г натриевой соли предельной монокарбоновой кислоты с избытком гидроксида натрия выделилось 4,48 л (н.у.) газа.
1) произведите необходимые вычисления,
2) напишите уравнение реакции сплавления в общем виде,
3) определите молекулярную формулу выделившегося газа,
4) напишите уравнение реакции монокарбоновой кислоты с метанолом.
8. В 17,7% раствор первичного алифатического амина массой 200 г пропустили избыток хлороводорода. После упаривания раствора получили белое кристаллическое вещество, содержащее 37,17% хлора по массе. На основании этих данных:
1) произведите необходимые вычисления,
2) определите молекулярную формулу амина,
3) напишите структурную формулу амина, если атом азота в молекуле амина связан со вторичным атомом углерода,
4) определите объем (н.у.) израсходованного хлороводорода3
9. 1,85 г предельной одноосновной органической кислоты нейтрализовали водным раствором гидрокарбоната натрия. При пропускании выделившегося газа через избыток раствора гидроксида бария получено 4,925 г осадка.
1) произведите необходимые вычисления,
2) определите молекулярную формулу кислоты,
3) напишите структурные формулы двух изомеров этой кислоты,
4) напишите уравнение реакции этой кислоты с хлором в присутствии красного фосфора.
10. При гидролизе сложного эфира с молярной массой 116 г/моль образуется кислота А и спирт Б. Определите строение эфира, если известно, что серебряная соль кислоты А содержит 19,16% кислорода, а спирт Б не окисляется дихроматом натрия.
1) произведите необходимые вычисления,
2) определите молекулярную формулу кислоты А,
3) определите молекулярную формулу спирта Б,
4) определите молекулярную формулу сложного эфира.
11. Массовая доля углерода в предельном одноатомном спирте равна 0,6818. Молекула спирта содержит четвертичный атом углерода
1) произведите необходимые вычисления,
2) установите простейшую формулу спирта,
3) напишите структурную формулу спирта,
4) напишите уравнение реакции взаимодействия этого спирта с уксусной кислотой.
12. Предельный вторичный амин содержит 23,73% азота.
1) произведите необходимые вычисления,
2) установите брутто-формулу амина,
3) определите молекулярную формулу амина,
4) напишите уравнение реакции этого амина с соляной кислотой.
13. Предельный альдегид содержит 18,60% кислорода. Молекула альдегида содержит четвертичный атом углерода.
1) произведите необходимые вычисления,
2) установите простейшую формулу альдегида,
3) определите структурную формулу альдегида,
4) напишите уравнение реакции “серебряного зеркала” для этого альдегида.
14. При сгорании 31,2 г углеводорода образовались 105,6 г оксида углерода(IV) и вода. Относительная плотность паров этого углеводорода по аргону равна 1,95.
1) произведите необходимые вычисления,
2) определите объем израсходованного кислорода (н.у.),
3) установите простейшую формулу углеводорода,
4) установите истинную формулу углеводорода.
15. При сжигании 8,8 г органического соединения образовалось 14,4 г воды и 13,44 л (н.у.) оксида углерода(IV). Относительная плотность паров этого соединения по аммиаку равна 2,588.
1) произведите необходимые вычисления,
2) установите простейшую формулу соединения,
3) установите истинную формулу соединения,
4) напишите структурную формулу продукта бромирования на свету этого соединения.
16. Дихлорид, полученный количественным присоединением 3,36 л (н.у.) хлора к алкену, при гидролизе водным раствором щелочи превратился в 11,4 г двухатомного спирта.
1) произведите необходимые вычисления,
2) установите простейшую формулу алкена,
3) напишите структурную формулу алкена,
4) напишите уравнение реакции полученного спирта с натрием.
17. Пронитровали 46,8 г ароматического углеводорода. Образовавшееся мононитропроизводное восстановили железом в кислой среде и получили вещество, которое полностью поглощает газ, выделяющийся при действии избытка концентрированной серной кислоты на 35,1 г хлорида натрия.
1) произведите необходимые вычисления, написав необходимые реакции,
2) установите формулу исходного ароматического углеводорода,
3) установите формулу продукта восстановления нитропроизводного,
4) напишите уравнение реакции продукта восстановления нитропроизводного с избытком бромной воды.
18. При окислении 7,4 г спирта с разветвленной углеводородной цепью получили кислоту с тем же числом атомов углерода. Для нейтрализации кислоты потребовалось 36,4 мл 10%-ного раствора гидроксида натрия плотностью 1,1 г/мл.
1) произведите необходимые вычисления,
2) установите простейшую формулу спирта,
3) напишите структурную формулу спирта,
4) напишите уравнение реакции окисления исходного спирта кислородом на медном катализаторе.
19. При действии натрия на 33,2 г смеси этанола и одноосновной предельной органической кислоты выделяется 6,72 л (н.у.) газа, а при действии на ту же смесь насыщенного раствора гидрокарбоната натрия — 8,96 л (н.у.) газа.
1) произведите необходимые вычисления,
2) определите массовую долю спирта в исходной смеси,
3) установите формулу кислоты,
4) напишите уравнение реакции взаимодействия этой кислоты с метанолом.
20. Смесь фенола и метилового эфира предельной монокарбоновой кислоты массой 39 г обработали 164 мл 20% -ного раствора гидроксида натрия (плотность 1,22 г/мл) при нагревании. Избыток щелочи нейтрализовали 43 мл 36%-ной соляной кислоты (плотность 1,18 г/мл). Если исходную смесь обработать избытком бромной воды, то образуется 33,1 г белого осадка.
1) произведите необходимые вычисления,
2) определите количество вещества гидроксида натрия, прореагировавшего с фенолом и эфиром вместе,
3) определите количество вещества фенола,
4) установите формулу кислоты, которая образует исходный эфир.
Ответы на тесты раздела 4.3.7
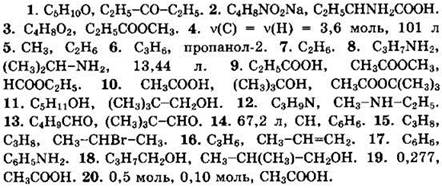
Решения тестов раздела 4.3.7
Решение 1. Общая формула кетона СnН2nО, тогда М(СnН2nО) = (14n + 16) г/моль. Из формулы видно, что в 1 моле кетона массой (14n + 16) г имеется 12n г углерода, 2n г водорода и 16 г кислорода. По условию w(Н) = 2n/(14n + 16) = 0,1163; откуда n = 5. Простейшая формула кетона: С5Н10О. При окислении кетонов в жестких условиях происходит разрыв связей С-С у карбонильной группы. Образование лишь двух кислот указывает на симметричный характер молекулы кетона. Молекулярная формула кетона С2Н5-СО-С2Н5 пентанон-3. Кетон окисляется до смеси СН3СООН и С2Н5СООН. В случае изомерного пентанона-2 при окислении образуется смесь четырех кислот. Кетон восстанавливается на никелевом катализаторе до пентанола-3: ![]()
Ответ: С5Н10О, С2Н5-СО-С2Н5.
Решение 2. Общая формула соли: NH2CmH2mCOONa или CnH2nNO2Na, где n = m + 1. M(CnH2nNO2Na) = (14n + 69) г/моль. Видно, что в 1 моль соли массой (14n + 69) г содержится 23 г натрия. w(Na) = 23/(14n + 69) = 0,184; откуда n = 4. Простейшая формула соли: C4H8NO2Na. Простейшая формула аминокислоты: C4H8NO2H. Молекулярная формула α-аминокислоты: C2H5CHNH2COOH. Уравнение реакции аминокислоты с этанолом: ![]()
![]()
Ответ: C4H8NO2Na, C2H5CHNH2COOH.
Решение 3. Общая формула эфира СnН2nО2, тогда М(СnН2nО2) = (14n + 32) г/моль. Видно, что в 1 моле эфира массой (14n + 32) г содержится 32 г кислорода. w(О) = 32/(14n + 32) = 0,3636; откуда n = 4. Простейшая формула эфира: С4Н8O2. Молекулярная формула эфира С2Н5СООСН3. Уравнение реакции гидролиза: ![]()
![]()
Ответ: С4Н8O2, С2Н5СООСН3.
Решение 4. Общая формула углеводорода СxНy
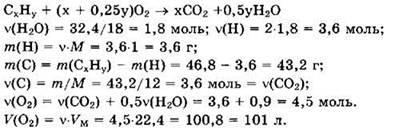
Ответ: v(C) = v(H) = 3,6 моль, 101 л.
Решение 5. При пропускании углекислого газа в избыток раствора гидроксида кальция образуется осадок карбоната бария.
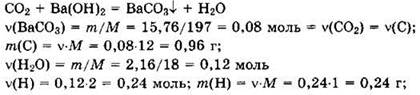
![]()
Соединение состоит только из углерода и водорода.
Общая формула углеводорода: СxНy ![]()
Простейшая формула углеводорода — СН3.
М(СН3) = 15 г/моль.
Зная относительную плотность соединения по аммиаку ![]() имеем
имеем ![]()
![]() Истинная формула углеводорода — С2Н6.
Истинная формула углеводорода — С2Н6.
Уравнение реакции горения этана: ![]()
![]()
Ответ: СН3, С2Н6.
Решение 6. Общая формула алкена СnН2n. Находим
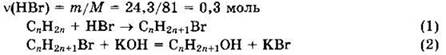
Из уравнений видно, что ![]()
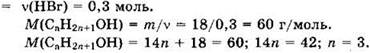
Формула алкена: С3Н6.
Уравнения реакций: ![]()
![]() и
и ![]() Полученный спирт — пропанол-2
Полученный спирт — пропанол-2
Ответ: С3Н6, пропанол-2.
Решение 7. Общая формула соли: CnH2n+1COONa.
![]()
Выделившийся газ — СnН2n+2.
![]()
![]()
Из уравнения видно, что ![]()
![]()
![]()
Молекулярная формула газа: С2Н6. Уравнение реакции кислоты с метанолом: ![]()
Ответ: С2Н6.
Решение 8. Общая формула первичного амина: CnH2n+1NH2.
![]()
![]() Из формулы видно, что в 1 моле соли массой (14n + 53,5) г содержится 35,5 г хлора.
Из формулы видно, что в 1 моле соли массой (14n + 53,5) г содержится 35,5 г хлора.
![]()
![]()
Формула амина — C3H7NH2. Структурная формула амина: (CH3)2CH-NH2.
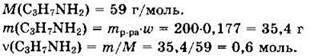
Из уравнения видно, что v(HCl) = v(C3H7NH2) = 0,6 моль.
![]()
Ответ: C3H7NH2, (CH3)2CH-NH2, 13,44 л.
Решение 9. Общая формула кислоты СnН2n+1СООН.
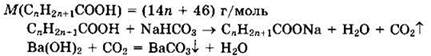
Осадок — это ВаСO3. ![]()
![]()
Из уравнений видно, что ![]()
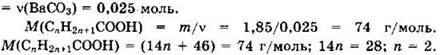
Формула кислоты С2Н5СООН. Формулы изомеров: СН3СООСН3, НСООС2Н5.
Уравнение реакции: ![]()
![]()
Ответ: С2Н5СООН, СН3СООСН3, НСООС2Н5.
Решение 10. Общая формула сложного эфира ![]()
Общая формула соли ![]()
![]()
Из формулы соли видно, что 1 моль соли массой (14n + 153) г содержит 32 г кислорода.
![]()
Кислота — СН3СООН. Эфир — СН3СООСmН2m+1
![]()
![]() Спирт С4Н9ОН.
Спирт С4Н9ОН.
Не окисляются дихроматом калия третичные спирты. Из четырех спиртов, соответствующих приведенной формуле, такой спирт один — (СН3)3СОН трет-бутиловый спирт или 2-метилпропанол-2. Эфир — это трет-бутиловый эфир уксусной кислоты СН3СООС(СН3)3.
Ответ: СН3СООН, (СН3)3СОН, СН3СООС(СН3)3.
Решение 11. Общая формула одноатомного спирта ![]() Из формулы спирта следует, что в 1 моле спирта массой (14n + 18) г содержится 12n г углерода. По условию w(С) = 12n/(14n + 18) = 0,6818; откуда n = 5. Молекулярная формула спирта: С5Н11ОН. Структурная формула спирта (СН3)3С-СН2ОН — это 2,2-диметилпропанол-1.
Из формулы спирта следует, что в 1 моле спирта массой (14n + 18) г содержится 12n г углерода. По условию w(С) = 12n/(14n + 18) = 0,6818; откуда n = 5. Молекулярная формула спирта: С5Н11ОН. Структурная формула спирта (СН3)3С-СН2ОН — это 2,2-диметилпропанол-1.
Уравнение реакции: ![]()
![]()
Ответ: С5Н11ОН, (СН3)3С-СН2ОН.
Решение 12. Общая формула амина CnH2n+3N. M(CnH2n+3N) = (14n + 17) г/моль
Из формулы амина видно, что в 1 моле амина массой (14n + 17) г содержится 14 г азота. По условию w(N) = 14/(14n + 17) = 0,2373; откуда n = 3. Молекулярная формула амина: C3H9N. Имеется четыре изомера: пропиламин, изопропил амин, метилэтиламин, триметиламин. Вторичный амин — один, метилэтиламин CH3-NH-C2H5.
Уравнение реакции: ![]()
![]()
Ответ: C3H9N, CH3-NH-C2H5.
Решение 13. Общая формула альдегида СnН2nО. М(СnН2nО) = (14n + 16) г/моль. Из формулы альдегида видно, что в 1 моле альдегида массой (14n + 16) г содержится 16 г кислорода. По условию w(О) = 16/(14n + 16) = 0,1860; откуда n = 5. Формула: С5Н10О или С4Н9СНО. Имеется четыре изомера: пентаналь, 2-метилбутаналь, 3-метилбутаналь, 2,2-диметилпропаналь. Четвертичный атом азота имеется только у 2,2-диметилпропаналя (СН3)3С-СНО.
Уравнение реакции: ![]()
![]()
Ответ: С4Н9СНО, (СН3)3С-СНО.
Решение 14. Общая формула углеводорода — СxНy.
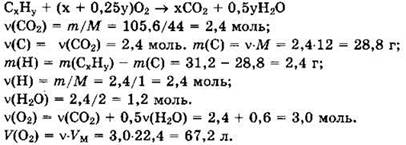
Для СxНy имеем х : у = 2,4 : 2,4 = 1 : 1. Простейшая формула углеводорода СН. М(СН) = 13 г/моль. Имеем ![]() Видно, что х = у = 78/13 = 6. Истинная формула углеводорода С6Н6, бензол.
Видно, что х = у = 78/13 = 6. Истинная формула углеводорода С6Н6, бензол.
Ответ: 67,2 л, СН, С6Н6.
Решение 15. Имеем ![]()
![]() отсюда
отсюда ![]()
![]()
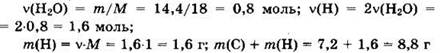
Соединение состоит только из углерода и водорода.
Общая формула углеводорода: СxНy
х : у = v(C) : v(H) = 0,6 : 1,6 = 3 : 8.
Простейшая формула С3Н8. М(С3Н8) = 44 г/моль.
Зная относительную плотность углеводорода по аммиаку D = M(CxHy)/M(NH3) = 2,588, имеем М(СxНy) = 2,588 ∙ M(NH3) = 2,588 ∙ 17 = 44 г/моль
Истинная формула совпадает с простейшей — С3Н8. Уравнение реакции бромирования: ![]()
![]()
Ответ: С3Н8, С3Н8, СН3-СНВr-СН3.
Решение 16. Общая формула алкена:
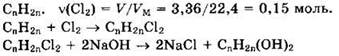
Из уравнений видно, что
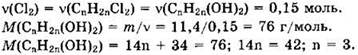
Формула алкена — C3H6.
Структурная формула алкена СН3-СН=СН2.
Уравнение реакции: ![]()
![]()
Ответ: С3Н6, СН3-СН=СН2.
Решение 17. Общая формула вещества: СnН2n-6.
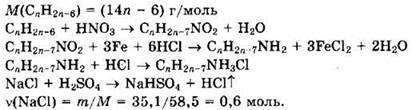
Из уравнений реакций видно, что
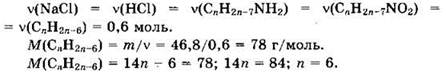
Формула углеводорода — С6Н6. Это бензол.
При восстановлении нитробензола образуется анилин C6H5NH2.
Уравнение реакции бромирования анилина:
![]()
Ответ: С6Н6, C6H5NH2.
Решение 18. Общая формула спирта СnН2n+1СН2ОН, так как до кислот окисляются только первичные спирты.
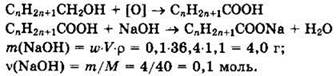
Из уравнений реакции видно, что ![]()
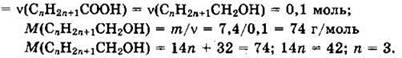
Простейшая формула спирта: С3Н7СН2ОН. Структурная формула спирта с разветвленной углеродной цепью: СН3-СН(СН3)-СН2ОН, 2-метилпропанол-1.
Уравнение реакции: ![]()
![]()
Ответ: С3Н7СН2ОН, СН3-СН(СН3)-СН2ОН.
Решение 19. Общая формула кислоты CnH2n+1COOH.
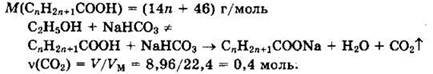
Из уравнения видно, что ![]()
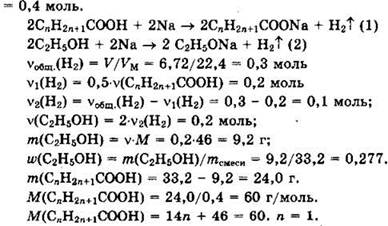
Формула кислоты СН3СООН.
Уравнение реакции: ![]()
Ответ: 0,277, СН3СООН.
Решение 20. ![]()
![]()
![]()
С фенолом и эфиром реагировало: v(NaOH) = 1 - 0,5 = 0,5 моль.
Общая формула эфира CnH2n+1COOCH3
![]()
С бромной водой реагировал только фенол:
![]()
Из уравнения имеем n(С6Н5ОН) = v(С6Н2Вr3) = 0,10 моль
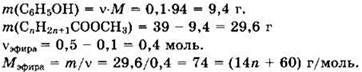
14n = 14; n = 1. Кислота СН3СООН.
Ответ: 0,5 моль, 0,10 моль, СН3СООН.