Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Между известными на сегодня 15 миллионами веществ возможны миллиарды самых различных химических реакций. Для того чтобы только записать все возможные уравнения реакций, не хватит человеческой жизни. А уж запомнить их невозможно даже современному компьютеру. С целью первоначального изучения химии полезно классифицировать эти всевозможные процессы. Огромное число химических реакций может быть разбито на несколько типов, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Изменение степеней окисления химических элементов в ходе реакции.
3. Знак теплового эффекта реакции.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
Реакции соединения. В ходе реакций соединения из нескольких более простых по составу реагирующих веществ получается одно, более сложное по составу, вещество:
А + В + С = D.
Как правило, эти реакции сопровождаются выделением теплоты, т.е. приводят к образованию более устойчивых соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения степеней окисления, например:
![]()
так и с изменением степеней окисления:
2SO2 + O2 = 2SO3.
Реакции присоединения протекают и с участием органических соединений, например — реакции гидратации и гидрирования:
![]()
Реакции разложения. В ходе реакций разложения из одного более сложного по составу вещества образуются несколько более простых по составу соединений:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества, например:
![]()
Из реакций разложения, протекающих без изменения степеней окисления, отметим разложение кристаллогидратов, гидроксидов, кислородсодержащих кислот и некоторых солей:
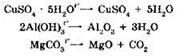
К реакциям разложения, происходящим с изменением степеней окисления, относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления, например:
![]()
Реакции разложения существуют и в органической химии, среди них, например, реакции крекинга:
![]()
или дегидрирования:
![]()
Реакции замещения. Реакцией замещения называют взаимодействие простого вещества и сложного, в ходе которого атомы простого вещества замещают один из элементов, входящих в состав сложного вещества. Примеры таких реакций приведены ниже:
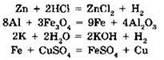
В органической химии реакции замещения имеют свою специфику, с которой вы познакомитесь в старших классах. Так, к реакциям замещения относится хлорирование метана:
![]()
Практически все реакции замещения сопровождаются изменением степеней окисления элементов, т.е. являются окислительно-восстановительными.
Реакции обмена. Реакциями обмена принято называть реакции между двумя сложными веществами, в ходе которых сложные вещества обмениваются между собой своими составными частями:
АВ + CD = AD + ВС.
В отличие от реакций замещения, реакции обмена протекают без изменения степеней окисления элементов. Это наиболее распространенная группа реакций между сложными веществами — оксидами, основаниями, кислотами и солями, например:
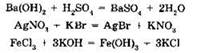
Частный случай реакций обмена — хорошо вам известная реакция нейтрализации:
HNO3 + NaOH = NaNO3 + Н2O
Классификация реакций по изменению степеней окисления химических элементов
В ходе химических реакций элементы могут как не изменять степени окисления, например:
![]()
так и изменять их:
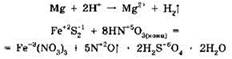
Реакции, протекающие с изменением степеней окисления, называют окислительно-восстановительными. Окислительно-восстановительные реакции чрезвычайно распространены как в живой природе, так и в промышленной химии. Выплавка и очистка металлов, фотографические процессы, реакция фотосинтеза, получение аммиака и неорганических кислот, производство медикаментов и строительных материалов, реакции горения, дыхания — вот далеко не полный список окислительно-восстановительных процессов, с которыми сталкивается человечество. Ниже мы ещё раз вернёмся к окислительно-восстановительным свойствам неорганических соединений.
Классификация реакций по тепловому эффекту
В зависимости от теплового эффекта химические реакции подразделяются на экзотермические и эндотермические. Экзотермическими называют реакции, протекающие с выделением энергии, например:
2Mg + O2 = 2MgO + Q
Примерами многочисленных экзотермических реакций являются: горение веществ на воздухе или в кислороде, взаимодействие металлов и неметаллов с галогенами, реакции нейтрализации, взаимодействие щелочных металлов с водой, взаимодействие активных металлов с кислотами и т. д.
Реакции, сопровождающиеся поглощением энергии, называют эндотермическими:
CaCO3 = СаО + СO2 —Q
Как правило, реакции разложения протекают с поглощением энергии, а присоединения — с выделением энергии. Но и здесь есть свои исключения. Так, реакция взаимодействия азота и кислорода (реакция соединения) является эндотермической, а разложение перманганатов или хлоратов — реакции экзотермические:
![]()
Кроме рассмотренных признаков, химические реакции можно классифицировать:
— по признаку обратимости (обратимые и необратимые химические процессы),
— по фазовым признакам (газовые, в растворе, твёрдофазные, гомогенные, гетерогенные),
— по необходимости использовать катализатор (каталитические и некаталитические) и по ряду других признаков.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Реакция, протекающая по уравнению
![]()
относится к реакциям
1) обмена
2) соединения
3) замещения
4) разложения
2. Какому типу соответствует реакция, протекающая по уравнению
![]()
1) обмена
2) соединения
3) разложения
4) замещения
3. Какое из приведенных уравнений соответствует реакции нейтрализации?
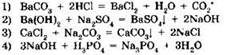
4. Окисление аммиака:
![]()
является реакцией
1) каталитической, эндотермической
2) каталитической, экзотермической
3) некаталитической, экзотермической
4) некаталитической, эндотермической
5. Взаимодействие водорода с хлором относится к реакциям
1) разложения, эндотермическим
2) обмена, экзотермическим
3) соединения, эндотермическим
4) соединения, экзотермическим
6. Взаимодействие кальция и соляной кислоты относится к реакциям
1) соединения, экзотермическим
2) замещения, экзотермическим
3) обмена, экзотермическим
4) замещения, эндотермическим
7. К практически необратимым реакциям относится взаимодействие между
1) N2 И Н2
2) SO2 и O2
3) С и O2
4) Н2 и S
8. Какая из перечисленных реакций является окислительно-восстановительной?
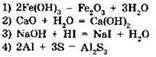
9. Реакция, уравнение которой
![]()
относится к реакциям
1) разложения
2) соединени.
3) замещения
4) обмена
10. Реакция, уравнение которой
![]()
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
11. К реакциям ионного обмена относится реакция, уравнение которой
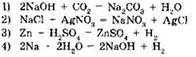
12. К окислительно-восстановительным реакциям относится реакция, уравнение которой
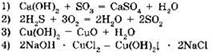
13. Взаимодействие гидроксида кальция с соляной кислотой относится к реакциям
1) соединения
2) обмена
3) разложения
4) замещения
14. Взаимодействие цинка с соляной кислотой относится к реакциям
1) замещения
2) соединения
3) разложения
4) обмена
15. Окисление сероводорода
![]()
является реакцией
1) окислительно-восстановительной, некаталитической, экзотермической
2) окислительно-восстановительной, каталитической, эндотермической
3) замещения, некаталитической, эндотермической
4) обмена, некаталитической, экзотермической
16. Серная кислота в растворе вступает в реакцию замещения с
1) железом
2) гидроксидом цинка
3) нитратом бария
4) оксидом меди(II)
17. Реакции нейтрализации соответствует уравнение:
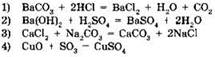
18. Гидроксид калия вступает в реакцию нейтрализации с
1) оксидом серы(VI)
2) сульфатом меди(II)
3) азотной кислотой
4) хлоридом железа(III)