Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Уже в середине XIX в. было установлено, что есть вещества, водные растворы которых (или расплавы) проводят электрический ток, водные же растворы других веществ электрического тока не проводят. Соответственно эти различные вещества получили название электролитов и неэлектролитов.
Электролиты — вещества, водные растворы которых или расплавы проводят электрический ток. Неэлектролиты — вещества, водные растворы которых не проводят электрический ток.
К электролитам относятся соли, кислоты, основания. Так, типичными электролитами являются:
— кислоты (НСl, HNO3, H2SO4, Н3РO4, СН3СООН, HF и др.);
— основания (КОН, NaOH, Са(ОН)2, Ва(ОН)2, NH3 ∙ Н2O и др.);
— соли (NaCl, K2SO4, Ca(NO3)2, CH3COONa, NH4Cl и др.).
Большинство органических веществ электролитами не являются. Так, не относятся к электролитам углеводороды, спирты, альдегиды, углеводы и др.
Электропроводность электролитов обусловлена присутствием в их растворах (или расплавах) ионов, которые и обеспечивают прохождение электрического тока. Для объяснения электропроводности водных растворов кислот, солей и оснований С. Аррениус выдвинул в 1887 г. теорию электролитической диссоциации.
В соответствии с этой теорией, электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные. Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами.
В общем виде диссоциация электролита KatAn может быть записана так:
![]()
На самом деле в водных растворах катионы металлов и анионы кислотных остатков существуют в гидратированном виде. Например, состав гидратированных катионов алюминия может быть записан так: [Аl(ОН)6]3+. Именно гидратация ионов является главной движущей силой механизма электролитической диссоциации, т. к. энергия гидратации ионов довольно высока и вполне достаточна для разрушения прочных кристаллических решёток твёрдых веществ. Однако в уравнениях реакций для простоты гидратные молекулы воды опускают и записывают просто Аl3+. Другой движущей силой процесса диссоциации является высокое значение диэлектрической константы воды: ε(Н2O) = 81, т.е. вода в 81 раз ослабляет притяжение катионов и анионов по сравнению с вакуумом.
Наиболее легко диссоциируют вещества с ионным типом связи, это объясняется наличием уже имеющихся ионов в узлах кристаллической решётки. Диссоциация веществ с сильно полярными ковалентными связями протекает сложнее: в этом случае распад на ионы полярной молекулы проходит через стадию перехода полярной структуры в ионную под действием молекул воды. Вещества с малополярными ковалентными связями и неполярными связями диссоциировать не могут и не относятся к электролитам. Так, в ряду NaF — HF — Н2 способность веществ к электролитической диссоциации уменьшается, что связано с переходом типа связи от ионной (во фториде натрия) к ковалентной полярной (во фтороводороде) и к ковалентной неполярной (в водороде).
Все электролиты можно разделить на сильные и слабые. Сильные электролиты в разбавленных водных растворах полностью диссоциируют на ионы. К сильным электролитам относятся все щёлочи, многие кислоты (такие как НСlO4, НСlO3, НСl, HNO3, H2SO4, HMnO4 и некоторые другие), а также практически все соли (даже если они малорастворимы, т.к. в водном растворе не существуют “молекулы” солей). Слабые электролиты лишь в малой степени диссоциируют на ионы. К слабым электролитам относятся вода, органические кислоты (уксусная, щавелевая, лимонная и т.д.), многие неорганические кислоты (сернистая, сероводородная, плавиковая, азотистая, хлорноватистая и др.). В отличие от сильных электролитов, диссоциация слабых электролитов обратима, что отражают в уравнениях диссоциации:
![]()
(сильный электролит, диссоциация полная),
![]()
(слабый электролит, диссоциация обратима).
Для количественной характеристики меры диссоциации электролита используют понятие степени диссоциации. Степень диссоциации равна отношению числа молекул, продиссоциировавших на ионы, к исходному числу растворённых молекул:
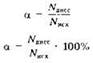
Таким образом, степень диссоциации может изменяться от 0 до 1 (или от 0 до 100%).
Степень диссоциации зависит от природы электролита, природы растворителя*, концентрации и температуры. Чем ниже концентрация электролита в растворе, тем больше степень его диссоциации. С ростом температуры степень диссоциации возрастает (т.к. диссоциация большинства электролитов — процесс эндотермический).
Электролитическая диссоциация кислот
С точки зрения теории электролитической диссоциации кислоты — это сложные вещества, при диссоциации которых в качестве катионов образуются только гидратированные ионы водорода H+и анионы кислотных остатков. Сильные кислоты диссоциируют практически полностью, например:
![]()
Диссоциация слабых кислот обратима:
![]()
Многоосновные кислоты диссоциируют ступенчато, по стадиям. Например, в случае слабой сероводородной кислоты можно записать:
![]()
При этом степень диссоциации по каждой последующей ступени намного меньше, чем по предыдущей. Так, степень диссоциации сероводородной кислоты по первой ступени составляет всего 1% (т.е. из 100 молекул H2S всего одна распадается на ионы). По второй ступени степень диссоциации ещё меньше и не превышает 10-7% (т. е. из 10 миллионов лишь один HS--ион распадается дальше на ионы, поэтому можно считать, что по второй стадии сероводород почти не диссоциирует).
Электролитическая диссоциация оснований
С точки зрения теории электролитической диссоциации основания — сложные вещества, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОH-. Сильные основания диссоциируют практически полностью:
![]()
Дисоциация слабых оснований обратима:
![]()
Многокислотные слабые основания диссоциируют ступенчато, по отдельным стадиям, например:
![]()
Как и в случае кислот, степень диссоциации по второй стадии намного меньше, чем по первой.
Электролитическая диссоциация солей
С точки зрения теории электролитической диссоциации соли — сложные вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. Практически все соли относятся к сильным электролитам, полностью распадаясь в водных растворах на ионы:
![]()
Даже в случае таких малорастворимых солей, как AgCl или BaSO4 (их растворимость мизерна и не превышает 10-5 моль/л), та часть их, которая перешла в раствор, полностью распадается на ионы:
![]()
Кислые и основные соли диссоциируют ступенчато. Так, гидросульфит натрия в водном растворе диссоциирует следующим образом:
![]()
Диссоциация по первой стадии протекает полностью (сильный электролит, как и все соли), по второй стадии — обратимо (слабый электролит, как и все многоосновные кислоты).
Электролитическая диссоциация амфотерных гидроксидов
Амфотерные гидроксиды могут одновременно диссоциировать и как основания, и как кислоты. Рассмотрим амфотерный гидроксид состава НОЭ, в котором при электролитической диссоциации может разрываться или О—Э-связь, или О—Н-связь. В первом случае гидроксид НОЭ будет диссоциировать как основание, во втором случае — как кислота:
как основание:
![]()
как кислота:
![]()
Так, гидроксид алюминия может диссоциировать и как основание:
![]()
и как кислота**:
![]()
Взаимодействуя с кислотами, гидроксид алюминия образует соли катиона Аl3+, а при реакции с щелочами — соли гидроксоалюминат-иона [Аl(ОН)4]-:
![]()
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. К неэлектролитам относится
1) расплав карбоната натрия
2) раствор этилового спирта
3) раствор бромоводорода
4) расплав хлорида калия
2. К электролитам относится
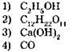
3. Хлорид-ионы образуются при электролитической диссоциации
![]()
4. Не является электролитом
![]()
5. Электролитической диссоциации ортофосфорной кислоты по второй ступени отвечает уравнение:
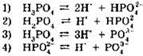
6. Не является электролитом
1) уксус
2) метан
3) сода
4) серная кислота
7. Электролитической диссоциации ортофосфорной кислоты по третьей ступени отвечает уравнение:
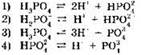
8. Не является электролитом
1) поваренная соль
2) щелочь
3) соляная кислота
4) спирт
9. Сумма коэффициентов в уравнении электролитической диссоциации сульфата алюминия равна
1) .
2) .
3) .
4) 4
10. Сильным электролитом является
1) угольная кислота
2) сероводородная кислота
3) серная кислота
4) сахароза
11. Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа(II) равна
1) .
2) .
3) .
4) 4
12. Слабым электролитом является
![]()
13. Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа(III) равна
1) 3
2) 4
3) 5 .
4) 6
14. К сильным электролитам не относится
![]()
15. Наибольшее количество ионов образуется при электролитической диссоциации 1 моль
1) хлороводорода
2) хлорида кальция
3) хлорида алюминия
4) хлорида железа(II)
16. К слабым электролитам не относится
![]()
17. Наибольшее количество ионов образуется при электролитической диссоциации 1 моль
1) сульфата калия
2) сульфата магния
3) сульфата алюминия
4) сульфата железа(II)
18. К электролитам относится
![]()
19. Сульфид-ионы образуются при электролитической диссоциации
![]()
20. К электролитам относится
![]()
21. Наибольшая концентрация фосфат-ионов в растворе
![]()
*Например, LiCl в воде — сильный электролит, а в спиртовом растворе — слабый.
**Раньше процесс электролитической диссоциации по кислотному типу записывали так:
![]()
что на самом деле не отвечает действительности. Причины этого рассматриваются в старших классах при углублённом изучении химии.